Assunzione per via orale di lavande vaginali prima e dopo l'avvio di una campagna di promozione televisiva. Le osservazioni effettuate dal CAV di Milano
Franca Davanzo1, Laura Settimi2, Fabrizio Sesana1, Giovanni Milanesi1, Pietro Maiozzi2, Elisabetta Urbani2, Luciana Cossa2, Maria Luisa Casini3, Fernanda Ferrazin3 e Alma Lisa Rivolta4
1Centro Antiveleni di Milano, Ospedale Niguarda Cà Granda, Milano
2Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute, Istituto Superiore di Sanità, Roma
3Agenzia Italiana del Farmaco, Roma
4Centro di Farmacovigilanza, Regione Lombardia, Milano
I preparati ginecologici a base di benzidamina cloridrato (BC), un antinfiammatorio non steroideo, commercializzati dalla principale azienda farmaceutica italiana per la produzione di questa tipologia di prodotti* sono passati nel 2009 dalla categoria medicinali senza obbligo di prescrizione medica ma non da banco a quella di medicinali da banco, rendendo in questo modo possibile la loro promozione attraverso campagne pubblicitarie rivolte al pubblico (1). Un primo intervento pubblicitario è stato basato su uno spot televisivo trasmesso in due periodi successivi: 20 dicembre 2009-2 gennaio 2010; 17-28 gennaio 2010. Nei giorni immediatamente successivi all’inizio della messa in onda dello spot, il Centro Anti-veleni (CAV) di Milano, principale centro di riferimento nazionale (2), è stato ripetutamente consultato per errori terapeutici da assunzione per via orale di lavande vaginali della marca pubblicizzata, causati da mancata comprensione della corretta modalità dell’uso. In data 8 gennaio 2010, il CAV di Milano ha trasmesso all’Agenzia Italiana del Farmaco (AIFA) le osservazioni riferite a 33 casi. Contemporaneamente, il Ministero della Salute ha richiesto la revisione dello spot televisivo allo scopo di evidenziare l’informazione sull’uso topico dei preparati. Il nuovo spot, rivisto e approvato dal Ministero, è stato trasmesso per la prima volta tra il 21 e il 27 febbraio 2010.
Il CAV di Milano, a seguito delle prime osservazioni effettuate, e anche su richiesta dell’AIFA, ha avviato un piano di lavoro per la caratterizzazione delle esposizioni ai preparati specifici e per seguirne l’andamento temporale. Tale iniziativa è stata concordata con l’Istituto Superiore di Sanità, nell’ambito del Sistema Informativo dedicato alle Esposizioni Pericolose e alle Intossicazioni (SIEPI) (3). Nel presente contributo vengono descritte le osservazioni effettuate nel corso di questa attività, con aggiornamento al 31 agosto 2010.
Sono stati estratti dal database del SIEPI tutti i casi esposti a preparati ginecologici a base di BC verificatisi nel periodo 2004-08 e notificati al Sistema dal CAV di Milano. I casi verificatisi nel 2009, non ancora acquisiti dal Sistema, sono stati estratti direttamente dall’archivio informatico del CAV e sottoposti alle procedure di revisione e codifica previste dal SIEPI. È stata inoltre attivata una procedura per l’identificazione e la revisione su base mensile dei nuovi casi rilevati a partire dal 1° gennaio 2010. A fini di analisi, la casistica è stata così suddivisa: I gruppo, comprendente i casi esposti tra il 1° gennaio 2004 e il 19 dicembre 2009, periodo antecedente l’avvio delle campagne pubblicitarie; II gruppo, comprendente i casi esposti durante la prima campagna pubblicitaria (20 dicembre 2009-28 gennaio 2010) e, successivamente, sino al 20 febbraio 2010; III gruppo, comprendente i casi esposti durante la seconda campagna pubblicitaria (21-27 febbraio 2010) e, successivamente, sino al 31 agosto 2010. Per il confronto tra gruppi è stato utilizzato il test χ2 di Pearson. Le analisi sono state effettuate con il software statistico STATA.
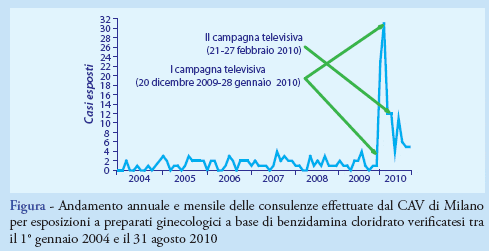
Complessivamente, sono stati identificati 201 casi, tutti risultati esposti a preparati ginecologici della marca pubblicizzata. Di questi, 95 sono risultati esposti nel I periodo di osservazione, 56 nel II e 50 nel III. Il rapporto tra numero di casi e periodo di osservazione espresso in giorni, è passato da 0,04 casi/die (I periodo) a 0,9 e 0,3 casi/die (I e II periodo, rispettivamente). Come evidenziato in Figura, nel I periodo, comprendente sei annualità, la numerosità della casistica è oscillata tra 0 e 4 casi mensili e tra 6 e 20 casi annui; nel II periodo sono stati rilevati 50 casi verificatisi nel corso della prima campagna pubblicitaria (20 dicembre 2009-28 gennaio 2010), pari a 1,8 casi/die, e 5 casi esposti tra il 1° e il 20 febbraio, pari a 0,2 casi/die; nel III periodo di osservazione, 7 casi sono stati rilevati durante la seconda campagna pubblicitaria (21-27 febbraio), pari a 1,0 casi/die. Successivamente, sono stati rilevati 12 casi nel mese di marzo, pari a 0,4 casi/die, 4 nel mese di aprile, pari a 0,1 casi/die, 11 nel mese di maggio, pari a 0,3 casi/die, 6 nel mese di giugno, pari a 0,3 casi/die, e 5 nei mesi di luglio e agosto, pari a 0,2 casi/die, rispettivamente. La casistica esaminata è pervenuta al CAV dall’intero territorio nazionale, senza variazioni nel corso del tempo. Le regioni con il numero più elevato di casi sono state: Lombardia (n. 58, 30%), Veneto (n. 24, 12%), Emilia-Romagna (n. 20, 10%), Puglia e Toscana (n. 15, 7%, rispettivamente). Analogamente, la distribuzione per tipologia di richiedente delle consulenze telefoniche è rimasta invariata nel tempo. Nel dettaglio, le richieste sono costantemente pervenute per circa il 55% (n. 111) dei casi da utenti extraospedalieri, principalmente cittadini (n. 65, 32%) e medici (n. 25, 12%), e per il 45% (n. 90) da servizi ospedalieri, principalmente Pronto Soccorso (n. 81, 40%). Tutti i casi esaminati sono risultati esposti in modo accidentale per via orale ai prodotti della marca pubblicizzata. Il preparato commerciale più frequentemente rilevato è stato quello in formulazione granulare da 500 mg in bustine monodose da sciogliere in acqua, per il quale sono stati rilevati 185 casi di esposizione, pari al 92% dell’intera casistica.
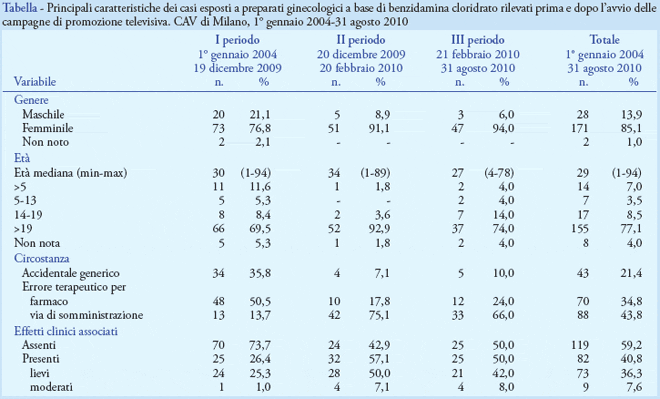
Come mostrato in Tabella, dopo l’avvio della campagna televisiva la casistica ha presentato variazioni nella distribuzione per genere, circostanza di esposizione e frequenza di intossicazioni. Per quanto riguarda il genere, è stato osservato un incremento della frequenza relativa dei soggetti di genere femminile, passati dal 77% nel I periodo al 91% e 95% nei successivi due (χ2 = 9,2623, gl =2, p < 0,006); la distribuzione per circostanza di esposizione ha evidenziato un incremento della proporzione di soggetti esposti per errore terapeutico da assunzione per via orale del farmaco, passati dal 14% nel I periodo, al 75% e 66% nei due periodi successivi (χ2=77,9162, gl = 2, p < 0,001). La percentuale di soggetti con segni e sintomi associati all’esposizione è passata dal 26%, rilevato nel I periodo, al 57% e 50% nei periodi successivi (χ2 = 10,3981, gl = 2, p < 0,001). Complessivamente, i casi di intossicazione sono stati 82, dei quali 72 (90%) di gravità lieve e 9 (10%) di gravità moderata. Per questi ultimi, le manifestazioni cliniche più frequentemente rilevate hanno compreso allucinazioni (6 casi), vertigini (3 casi), rallentamento motorio (2 casi), pirosi retrosternale e riduzione visus (1 caso, rispettivamente).
La problematica relativa all’errata via di assunzione di questi preparati ginecologici è stata sollevata a livello europeo (4) e altri Stati Membri hanno dichiarato di aver ricevuto notifiche di errori di somministrazione con medicinali ginecologici contenenti BC. In particolare, in uno studio condotto in Spagna, è stata documentata un’elevata frequenza di errori terapeutici per errata via di somministrazione tra gli esposti a preparati ginecologici contenenti BC (5). In Italia, tale modalità di esposizione è risultata poco frequente prima dell’avvio delle campagne pubblicitarie televisive per la promozione di preparati ginecologici della principale marca presente sul mercato, mentre la proporzione di casi esposti a questi prodotti per via orale a seguito di errore terapeutico è aumentata in modo rilevante dopo la loro pubblicizzazione. Nell’insieme, i dati disponibili indicano l’opportunità di un’attenta verifica delle modalità di promozione pubblicitaria di preparati ginecologici contenenti BC, al fine di garantire una chiara comunicazione sulle corrette modalità di utilizzo.
Ringraziamenti
Si ringrazia il Centro Antiveleni di Milano che ha collaborato alla raccolta dati: Tiziana Della Puppa, Marcello Ferruzzi, Angelo Roberto Travaglia, Francesca Assisi, Paola Angela Moro, Rossana Borghini, Maurizio Bissoli, Ilaria Rebutti, Valeria Dimasi, Michele Chiericozzi, Joannhe Georgatos, Paolo Severgnini.
Riferimenti bibliografici
1. Italia. Gazzetta Ufficiale n. 90, 18 aprile 2009. Supplemento ordinario n. 53.
2. Mucci N, Alessi M, Binetti R, et al. Profilo delle intossicazioni acute in Italia. Analisi dei dati registrati dai Centri Antiveleni. Ann Ist Super Sanità 2006; 42(3):268-76.
3. Settimi L, Davanzo F, Marcello I, et al. Implementazione di una nuova sorveglianza delle esposizioni pericolose. Not Ist Super Sanità 2008;21(4):3-9.
4. Pharmacovigilance Working Party (PhVWP). September 2010 plenary meeting. Montly Report - Issue number: 1009 ( www.ema.europa.eu/docs/...).
5. Ballestros S, Ramon MF, Martinez-Arrita R. Ingestion of benzydamine-containing vaginal preparation. Clin Toxicol 2009;47:145-9.
Note
(*) Preparati ginecologici denominati Tantum Rosa, prodotti e commercializzati dalle Aziende Chimiche Riunite Angelini Francesco (ACRAF) Spa

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale