Utilizzo dei farmaci biosimilari in Italia negli anni 2009-13*
Ylenia Ingrasciotta¹, Rosa Gini² e Gianluca Trifirò² per la Rete italiana di ricerca sui biosimilari tramite banche dati sanitarie**
¹Dipartimento di Scienze Biomediche, Odontoiatriche e delle Immagini Morfologiche e Funzionali, Università degli Studi di Messina;
²Agenzia Regionale di Sanità della Toscana, Firenze
SUMMARY (How much are biosimilars used in clinical practice? A retrospective Italian population-based study of erythropoiesis-stimulating agents in the years 2009-13) - A retrospective drug utilization study, aiming to explore the prescription pattern of erythropoiesis-stimulating agents (ESA), has been conducted in four large Italian geographic areas, where different health policy interventions to promote biosimilar use in routine care were undertaken during the years 2009-13. Overall, 41,286 patients were naive users of ESA in the four centers during the study years. The age-adjusted prevalence of ESA use decreased slightly, while use of biosimilars, especially in naive patients, increased significantly but to different extents in these areas. Switching between different ESA during the first year of therapy was frequent (17.0%), much more toward reference products than toward biosimilars.
Key words: erythropoiesis-stimulating agents; biosimilars; pattern of use
Introduzione
Un farmaco biologico è un prodotto medicinale nel quale il principio attivo è una sostanza di origine biologica, vale a dire prodotta o estratta da microrganismi, organi e tessuti di origine animale o vegetale, da cellule o fluidi di origine umana o animale, oppure derivata dalla tecnologia ricombinante (1).
L’introduzione dei farmaci biologici nella pratica clinica ha fortemente rivoluzionato il trattamento di numerose patologie, soprattutto croniche e di natura immuno-oncologica, quali l’artrite reumatoide e alcuni tipi di cancro (2).
Al momento della scadenza del brevetto dei farmaci biologici, i corrispondenti biosimilari, ovvero farmaci simili a un farmaco biologico originale già autorizzato (prodotto di riferimento) in termini di qualità, caratteristiche biologiche, attività, efficacia e sicurezza (3), possono essere immessi nel mercato europeo, in seguito ad approvazione da parte della European Medicines Agency (EMA). I farmaci biosimilari sono disponibili sul mercato europeo dal 2006 e hanno un prezzo d’acquisto inferiore del 20-30% rispetto al prodotto di riferimento (4). L’epoetina alfa (uno degli agenti stimolanti l’eritropoiesi, erythropoiesis-stimulating agents - ESA) è uno dei farmaci biologici per i quali i biosimilari sono attualmente disponibili sul mercato italiano, oltre a somatropina, filgrastim, follitropina alfa, enoxaparina sodica, infliximab, insulina glargine, insulina lispro, etanercept e rituximab.
Alla classe degli ESA appartengono, oltre all’epoetina alfa (prodotto di riferimento e biosimilare), l’epoetina beta, l’epoetina teta, la darbepoetina alfa e la metossipolietilenglicole-epoetina beta. Tali farmaci sono principalmente indicati nel trattamento dell’anemia associata a insufficienza renale cronica o a chemioterapia in pazienti oncologici. Recentemente il consumo di biosimilari di ESA è cresciuto in misura differente nelle varie regioni italiane (in generale +20,3% dal 2015 al 2016) (5), anche e soprattutto in funzione delle diverse normative e dei diversi interventi di politica sanitaria adottati.
Nel 2009, la Campania è stata la prima regione in Italia a imporre l’uso dei biosimilari come trattamento di prima scelta nei pazienti naive (DC n. 15, 30 novembre 2009), seguita nel 2010 dalla Toscana (Decreto n. 592, 7 giugno 2010) e dal Veneto (Linee guida per l’impiego e l’acquisto dei farmaci biosimilari: parere espresso dalla Commissione Terapeutica del Prontuario Terapeutico Ospedaliero Regione Veneto, 11 novembre 2010) e infine dalla Sicilia nel 2014 (DA n. 540, 2 aprile 2014).
A oggi non sono disponibili dati sull’uso dei biosimilari degli ESA nella popolazione generale italiana. L’obiettivo di questo studio è la valutazione del pattern prescrittivo di ESA (biosimilari, prodotti di riferimento e farmaci ancora coperti da brevetto) negli anni 2009-13 in quattro aree geografiche italiane, dove sono stati adottati diversi interventi di politica sanitaria.
Materiali e metodi
È stato condotto uno studio osservazionale, retrospettivo, multicentrico di farmacoutilizzazione. I dati anonimizzati sono stati estratti dalle banche dati amministrative della regione Toscana e delle ASL di Caserta, Palermo e Treviso, e hanno incluso una popolazione di più di 6,5 milioni di soggetti negli anni 2009-13. Relativamente all’ASL di Palermo, i dati erano disponibili per il periodo 2011-13. Ogni ASL ha raccolto i dati amministrativi inerenti le dispensazioni di ESA, le diagnosi registrate al momento della dimissione ospedaliera/pronto soccorso, le esenzioni per patologia.
Sono stati identificati tutti i pazienti con almeno un anno di registrazione dei dati nelle banche dati e con almeno una dispensazione di un ESA durante il periodo in studio. Successivamente sono stati identificati gli utilizzatori naive di ESA, ovvero gli utilizzatori che, al momento della prima dispensazione dei farmaci nel periodo in studio (data indice, DI), non avevano ricevuto nessuna dispensazione di ESA nell’anno precedente. Gli utilizzatori naive sono stati caratterizzati in termini demografici e per indicazione d’uso; questa è stata dedotta dai piani terapeutici nelle aree dove il dato era disponibile e approssimata dai dati amministrativi nelle altre aree. Successivamente sono stati classificati come utilizzatori di originator (Eprex®, Globuren®, Neorecormon®, Aranesp®, Nespo®, Eporatio ®, Mircera®) o di biosimilari dell’epoetina alfa (Binocrit®, Abseamed® e Retacrit®), considerando il tipo di ESA dispensato alla DI.
Sono state calcolate la prevalenza d’uso centro-specifica aggiustata per fasce d’età e la proporzione di utilizzatori di biosimilari sul totale di utilizzatori di ESA, stratificate per anno e per centro. La prevalenza d’uso centro-specifica aggiustata per fasce d’età è stata calcolata tramite standardizzazione diretta. La frequenza d’uso dei biosimilari di ESA è stata calcolata sul totale degli utilizzatori dei farmaci studio e stratificata nel tempo e per i differenti centri.
Sono state condotte analisi sullo switch tra i diversi ESA durante il primo anno di trattamento dopo la DI. È stato considerato solo il primo switch dopo la DI.
Gli utilizzatori di Globuren® (epoetina alfa) sono stati raggruppati insieme agli utilizzatori di Eprex®, in quanto tali prodotti risultano in co-marketing; allo stesso modo, gli utilizzatori di Nespo® sono stati raggruppati con gli utilizzatori di Aranesp®.
In entrambi gli studi, lo switching pattern è stato graficamente rappresentato utilizzando il software Cytoscape (6) e tutte le analisi statistiche sono state condotte utilizzando SAS per Windows, versione 9.2.
Risultati
Durante il periodo in studio, su una popolazione complessiva di 6.571.697 soggetti (più del 10% dell’intera popolazione italiana), 49.491 (0,8%) soggetti hanno ricevuto almeno una prescrizione di ESA negli anni 2009-13. Di questi, 41.286 (83,4%) erano utilizzatori naive, la maggior parte dei quali ha iniziato il trattamento con un originator (n. 32.430; 78,5%) rispetto al biosimilare (n. 8.856; 21,5%). Le distribuzioni di età e sesso non hanno mostrato differenze tra gli utilizzatori di biosimilare o di originator.
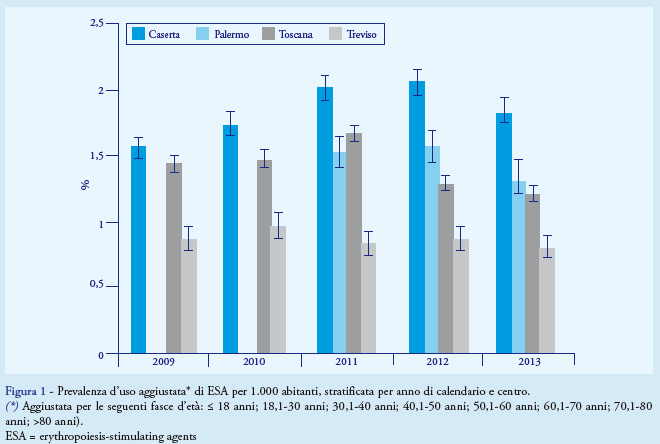
La prevalenza d’uso di ESA aggiustata per età ha mostrato un incremento da 1,0‰ nel 2009 a 1,5‰ nel 2011, con un leggero decremento nei 2 anni successivi. In particolare, la prevalenza d’uso nell’ASL di Caserta è risultata maggiore nei primi 4 anni dello studio (1,6- 2,1‰ nel periodo 2009-12, con una riduzione successiva di 1,8‰ nel 2013), rispetto ai centri di Treviso, Palermo e Toscana (Figura 1).
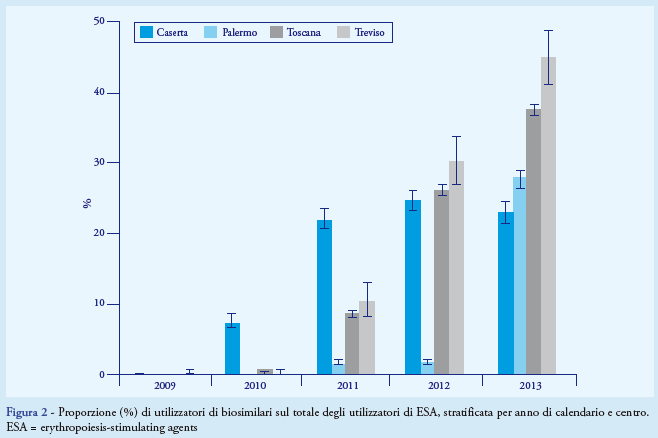
È stato osservato un aumento nel tempo della proporzione di utilizzatori di ESA biosimilari sul totale degli utilizzatori ESA nelle quattro aree geografiche, dall’1,8% nel 2010 al 33,6% nel 2013 (Figura 2 ). In particolare, si è registrato un incremento maggiore a Treviso (0-45,0%) e in Toscana (0,7-37,6%), rispetto a Caserta (7,5-22,9%) e Palermo (0-27,7%).
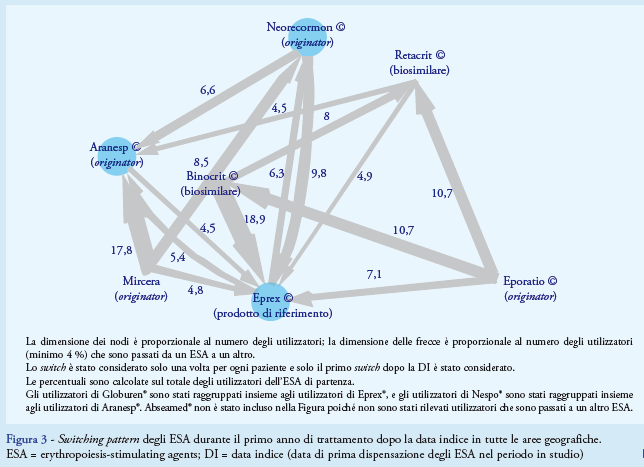
Lo switch durante il primo anno di trattamento è risultato essere un fenomeno molto frequente (17,0% di tutti gli utilizzatori di ESA), soprattutto verso un originator (84,1% degli switcher) rispetto al biosimilare (15,9%) (Figura 3).
Discussione
Questo studio rappresenta uno dei primi studi di popolazione relativi al pattern d’utilizzo degli ESA in un lungo periodo di tempo e in un’ampia coorte di pazienti italiani provenienti da diverse aree geografiche.
Nonostante l’uso complessivo degli ESA si sia leggermente ridotto negli anni 2012-13, l’uso dei farmaci biosimilari è aumentato significativamente dal 2009 al 2013 in tutte le quattro aree geografiche italiane considerate. Analogamente a quanto riscontrato in un precedente lavoro (7), è stato osservato un elevato grado di eterogeneità nell’uso di questi farmaci nelle diverse regioni italiane, probabilmente legata ai diversi interventi di politica sanitaria atti a promuovere l’uso degli stessi biosimilari.
In Sicilia e in Campania, nel caso in cui non veniva prescritto il farmaco biologico a minor costo ai pazienti naive o non veniva fornita adeguata motivazione per tale scelta, il costo relativo alla prescrizione era direttamente addebitato al prescrittore (DA n. 540, 17 giugno 2014 , DC n. 44, 14 luglio 2010). In Toscana e a Treviso, invece, sono state annualmente stabilite delle soglie minime di consumo di biosimilari, in termini di dose definita die (DDD)/1.000 abitanti/die o unità posologiche o confezioni (DGR n. 644, 28 luglio 2014; DGR n. 2369, 29 dicembre 2011; Linee di indirizzo per l’appropriatezza prescrittiva dei farmaci nelle Aziende ULSS della Regione Veneto 20 maggio 2013; DGR n. 2533, 20 dicembre 2013), oltre che ulteriori budget per i prescrittori e i direttori generali, una volta raggiunti i sopra citati obiettivi di consumo (Treviso). Questi differenti approcci nelle politiche sanitarie, insieme alle eventuali differenze regionali nella commercializzazione dei biologici da parte delle aziende farmaceutiche e allo scetticismo dei clinici circa la comparabilità del prodotto di riferimento e del biosimilare, rappresentano i diversi fattori che potrebbero aver contribuito all’eterogeneità nell’uso dei biosimilari degli ESA in Italia.
Inoltre, gli interventi di politica sanitaria regionali adottati nei quattro centri specificano che i pazienti naive debbano essere trattati con biosimilari (qualora disponibili) ma che, allo stesso tempo, debba essere assicurata la continuità terapeutica ai pazienti in trattamento cronico. D’altro canto, i risultati evidenziano che durante il primo anno di trattamento il fenomeno dello switch si è verificato piuttosto frequentemente (17% degli utilizzatori di ESA, risultato in linea con quello di uno studio (8) di farmaco-utilizzazione condotto nell’ASL di Messina), probabilmente a causa di inefficacia terapeutica, intesa come mancato raggiungimento del target terapeutico (valore minimo di Hb), di ridotta tollerabilità o della preferenza del clinico/paziente nei confronti di uno degli ESA (per le differenze nella frequenza e nella via di somministrazione, che potrebbero influenzare la compliance del paziente) (9).
A proposito dell’intercambiabilità del prodotto di riferimeno e del biosimilare nei pazienti già in trattamento, il dibattito è ancora aperto. Per diverse ragioni, la sostituzione tra i diversi farmaci biologici appartenenti alla stessa classe spesso non è raccomandata dalle società scientifiche, ma le decisioni ufficiali spettano sempre alle singole agenzie regolatorie nazionali (10). Riferendosi a quanto stabilito dal Medical Evaluation Board (Olanda), la sostituzione tra farmaci biologici (indipendentemente che si tratti di prodotto di riferimento o biosimilare) è consentita, ma solo dopo adeguato monitoraggio clinico e dopo aver correttamente informato il paziente (11). In Italia, il position paper dell’AIFA, invece, esclude la sostituzione terapeutica automatica del prodotto di riferimento con il biosimilare (12).
Un importante aspetto aggiuntivo da considerare nelle analisi sullo switch tra i diversi farmaci biologici è la difficoltà nell’eseguire il monitoraggio relativo alla farmacovigilanza. Infatti, qualora lo switch da un biologico all’altro sia la sospetta causa di un evento avverso, ma non sia disponibile alcuna documentazione a riguardo, al momento dell’analisi di farmacovigilanza tale evento non può essere ricondotto a uno specifico prodotto.
Il principale punto di forza dello studio è la possibilità di analizzare i dati sulle dispensazioni di ESA in diverse aree geografiche per un lungo periodo di tempo. Alla luce del fatto che il primo biosimilare degli ESA è stato introdotto in commercio nel 2007, è stato possibile analizzare l’impatto della loro immissione in commercio sul pattern prescrittivo in relazione ai diversi interventi di politica sanitaria. La disponibilità in alcuni centri (Treviso e Caserta) dei piani terapeutici elettronici fornisce informazioni sul nome della specialità medicinale, numero di scatole dispensate e sull’indicazione d’uso. Inoltre, tutti i database forniscono informazioni sui costi degli ESA, nonostante alcune differenze tra centri, flussi farmaceutici e anno di calendario. A ogni modo, i biosimilari hanno un costo di circa il 20-30% inferiore rispetto al prodotto di riferimento. Infine, considerando che lo studio è focalizzato su diverse aree geografiche del Nord, Centro e Sud Italia, i nostri risultati potrebbero non essere generalizzabili all’intera popolazione italiana, sebbene i risultati siano in linea con quelli presentati nel rapporto OsMed del 2014, il quale ha mostrato un aumento nel consumo del biosimilare dell’epoetina alfa e che il 56% dei nuovi pazienti trattati con epoetina alfa era trattato con il biosimilare dell’epoetina alfa, con un trend in crescita rispetto all’anno precedente (+54,6%) (13).
Considerato che nel prossimo futuro un certo numero di biosimilari verrà immesso in commercio, sono necessarie nuove strategie per promuovere l’uso dei farmaci biologici a minor costo e per valutare il loro impatto nelle diverse regioni italiane, con obiettivo finale la sostenibilità del Servizio Sanitario Nazionale.
(*) Lo studio è stato svolto nell’ambito del Progetto “Assessment of short and long term risk-benefit profile of biologics through healthcare database network in Italy”, finanziato dal Ministero della Salute ed è stato pubblicato sulla rivista BioDrugs (doi: 10.1007/s40259-015-0132-7) dove è possibile trovare ulteriori approfondimenti.
(**) Rete italiana di ricerca sui biosimilari tramite banche dati sanitarie: Francesco Giorgianni, Jenny Bolcato, Roberta Pirolo, Alessandro Chinellato, Daniele Ugo Tari, Chiara Troncone, Andrea Fontana, Valentina Ientile, Domenico Santoro, Mariacarmela Santarpia, Armando Genazzani, Ilaria Uomo, Maurizio Pastorello, Walter Pollina Addario, Salvatore Scondotto, Pasquale Cananzi, Achille Patrizio Caputi.
Dichiarazione sui conflitti di interesse
Gli autori dichiarano che non esiste alcun potenziale conflitto di interesse o alcuna relazione di natura finanziaria o personale con persone o con organizzazioni che possano influenzare in modo inappropriato lo svolgimento e i risultati di questo lavoro.
Riferimenti bibliografici
1. Coordination Group for Mutual Recognition and Decentralised Procedures. Questions & answers biologicals. CMDh/269/2012; October 2012.
2. Blackstone EA, Joseph PF. The Economics of Biosimilars. Am Health Drug Benefits 2013; 6(8):469-78.
3. European Medicines Agency. Guideline on similar biological medicinal products. CHMP/437/04. 23 October 2014.
4. Genazzani AA, Biggio G, Caputi AP, et al. Biosimilar drugs: concerns and opportunities. Bio Drugs 2007;21(6):351-6.
5. Agenzia Italiana del Farmaco. L’uso dei farmaci in Italia - Rapporto OsMed 2015.
6. www. cytoscape.org/
7. La Vecchia C, Franceschi S, Apolone G. Drug distribution and expenditure: the issue of epoetin in Italy. Eur J Public Health 2003;13(4):367.
8. Loiacono C, Sgroi C, Coppolino S, et al. How much are biosimilars used in southern Italy? A retrospective analysis of epoetin utilization in the local health unit of Messina in the years 2010–2011. BioDrugs 2012;26:113-20.
9. Lonnemann G, Wrenger E. Biosimilar epoetin zeta in nephrology - a single-dialysis center experience. Clin Nephrol 2011;75(1):59-62.
10. European Medicines Agency. EMA procedural advice for users of the centralised procedure for similar biological medicinal products applications.
11. Medicines Evaluation Board. Biosimilars medicines.
12. AIFA. Position Paper sui Farmaci Biosimilari (28/05/2013).
13. Agenzia Italiana del Farmaco. L’uso dei farmaci in Italia - Rapporto OsMed 2014.

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale