Verso il Registro Nazionale degli impianti Protesici Mammari: progettazione di uno strumento unico per migliorare la sicurezza dei pazienti
Marina Torrea, Veronica Maria, Paola Ciccarellia, Eugenio Carrania, Virgilia Toccacelib, Stefania Ceccarellia, Duilio Luca Bacoccoa, Lucia Lispic, Marco Ventimigliac, Achille Iachinoc, Antonella Campanalec
a Segreteria Scientifica del Presidente, Istituto Superiore di Sanità, Roma
b Centro di Riferimento per le Scienze Comportamentali e la Salute Mentale, Istituto Superiore di Sanità, Roma
c Direzione Generale dei Dispositivi Medici e del Servizio Farmaceutico, Ministero della Salute, Roma
Citare come segue: Torre M, Mari V, Ciccarelli P, Carrani E, Toccaceli V, Ceccarelli S, Bacocco DL, Lispi L, Ventimiglia M, Iachino A, Campanale A. Verso il Registro Nazionale degli impianti Protesici Mammari: progettazione di uno strumento unico per migliorare la sicurezza dei pazienti. Boll Epidemiol Naz 2023;4(1):9-17. DOI: https://doi.org/10.53225/BEN_060
Towards the Italian National Breast Implant Registry: design of a unique tool to improve patient safety
Introduction
The National Breast Implants Registry (NBIR) aims to monitor safety and performance of breast implants, assessing outcomes of the surgical procedures and tracing patients and implanted devices. This paper describes the RNPM pilot project development showing data regarding hospital enrollment since 2019.
Materials and methods
The NBIR Pilot IT platform was designed as a Proof of Concept. An expert panel was established to define the Minimum Data Set of information, the data collection flow, and the design of the privacy framework. To support data entry, breast implant distributors were asked to preload the marketed devices on the platform.
Results
For each surgery, data related to surgeon, health care facility, patient, procedure, and implanted or removed devices were included in the Minimum Data Set. The platform was released on 25/03/2019. From 25/03/2019 to 30/01/2023, 9,891 procedures performed on 9,677 patients in 186 structures of 18 Italian regions were voluntarily collected. Reconstructive surgeries represented 55.3% and aesthetic 44.7%; 75% of the collected procedures were primary surgeries.
Conclusions
Although data collected are not yet representative, data analysis returned interesting information suggesting that the structure designed for this registry can reach the purpose of enhancing patient safety. The coming into force of the Registry Regulation on 02/02/2023 has made participation compulsory. As soon as the six-month transient period will finished, a dramatic increase in the number of registrations is expected and the Registry will soon become a complete and effective tool to improve both patient safety and quality of healthcare, as required by EU Regulation 2017/745.
Key words: registries; prostheses and implants; public health
Introduzione
Nel mondo, si stimano circa 35 milioni di pazienti impiantati con una protesi mammaria (1). In ambito estetico, la mastoplastica additiva rappresenta circa il 13,1% di tutte le procedure di chirurgia plastica (2). In ambito ricostruttivo, nell’80% dei casi si utilizza una protesi mammaria per restituire volume e forma alla mammella (3).
Nel 2010 un importante incidente sulle protesi mammarie evidenziò, per le autorità competenti sui dispositivi medici, la necessità di disporre di strumenti in grado di rintracciare i pazienti impiantati in caso di necessità. Si trattava delle protesi mammarie di una ditta francese che, fraudolentemente e contravvenendo ai requisiti stabiliti dalla Direttiva Europea 93/42/EEC (4), erano state prodotte con silicone non conforme e per tale motivo erano soggette a un maggior rischio di rottura rispetto alle altre tipologie di protesi.
Tali strumenti sono stati identificati nei registri, definiti dall’International Medical Device Regulatory Forum (IMDRF) come un “sistema organizzato con l'obiettivo primario di aumentare le conoscenze sui dispositivi medici contribuendo a migliorare la qualità della cura del paziente. Tale sistema raccoglie continuamente dati di interesse, valuta risultati significativi e copre in modo completo la popolazione definita dall'esposizione a particolari dispositivi su scala ragionevolmente generalizzabile (ad esempio, sistema sanitario internazionale, nazionale, regionale)" (5). L’importante incidente sulle protesi mammarie e, contemporaneamente, anche quello sulle protesi ortopediche con accoppiamento metallo-metallo (6-8) ha spinto l’Europa, che stava ridisegnando la cornice normativa sui dispositivi medici con la stesura del nuovo Regolamento, a sottolineare l’importanza di istituire i registri dei dispositivi impiantabili (9).
Contemporaneamente, l’Italia ha risposto a questa emergenza emanando la legge con la quale individuava nel Ministero della Salute e nelle Regioni gli enti preposti all’istituzione, rispettivamente, del Registro Nazionale degli impianti Protesici Mammari (RNPM) e dei registri regionali. Con lo stesso provvedimento sono state definite le finalità dell’RNPM: monitoraggio clinico dei soggetti sottoposti a impianto per prevenire complicanze e migliorare la gestione clinicoassistenziale degli eventuali effetti indesiderati ed esiti a distanza; rintracciabilità in caso di specifiche necessità; monitoraggio epidemiologico a scopo di studio e ricerca scientifica in campo clinico e biomedico nonché ai fini della programmazione, gestione, controllo e valutazione dell’assistenza sanitaria (10).
Nel 2017, a seguito dell’approvazione del DPCM 3 marzo 2017 (11), che identifica oltre 50 registri e sistemi di sorveglianza tra cui, oltre all’RNPM, anche il Registro nazionale delle Protesi Impiantabili (RIPI), il Ministero della Salute e l’Istituto Superiore di Sanità (ISS) hanno collaborato alla progettazione del sistema di raccolta dati dell’RNPM, capitalizzando anche l’esperienza maturata dall’implementazione del Registro Italiano ArtroProtesi (RIAP) (12).
Obiettivo del presente lavoro è quello di descrivere il percorso seguito nella concezione, progettazione e costruzione della versione pilota dell’RNPM, mostrando i risultati delle analisi condotte sui dati raccolti dal 25 marzo 2019 al 30 gennaio 2023.
Materiali e metodi
Il progetto per la realizzazione dell’RNPM si è svolto nell’ambito di specifici accordi di collaborazione tra Ministero della Salute e ISS mirati a selezionare le variabili da collezionare, definire il flusso informativo, progettare e realizzare una piattaforma informatica Proof of Concept (POC-RNPM) che supportasse la fase pilota di raccolta dei dati, ponendo particolare attenzione all’impalcatura privacy.
Selezione delle variabili
Prendendo a riferimento i registri delle protesi mammarie evidenziati in una revisione della letteratura (13), sono state acquisite le schede di raccolta dati sviluppate dai registri già attivi nel Regno Unito, in Australia e nei Paesi Bassi. È stato, inoltre, preso in considerazione tutto quanto già definito dall’International Collaboration of Breast Registry Activities - ICOBRA (14). Per soddisfare sia le peculiarità di un registro nazionale italiano sia le best practice internazionali, con gli esperti del Ministero della Salute è stato effettuato un lavoro di confronto e di sintesi del materiale raccolto. Il risultato di tale attività è stato quindi condiviso con i referenti delle società scientifiche interessate dagli interventi di protesi mammaria (Società Italiana di Chirurgia Plastica, Ricostruttiva ed Estetica - SICPRE, Associazione Italiana di Chirurgia Plastica Estetica - AICPE e Associazione Nazionale Italiana Senologi Chirurghi - ANISC) arrivando alla definizione delle specifiche del dataset, contenente l’elenco minimo delle variabili e delle modalità necessarie a una raccolta dati completa ed efficace per il pieno raggiungimento delle finalità del Registro, elementi chiave per la successiva fase di progettazione della piattaforma.
Definizione del flusso informativo
Il flusso informativo dell’RNPM raccoglie l’esperienza decennale maturata dall’ISS con la realizzazione del RIAP. Analogamente al RIAP, infatti, l’RNPM è una struttura di coordinamento trasversale che governa una federazione di registri regionali. Il RIAP si basa sui seguenti pilastri: organizzazione federativa; utilizzo di flussi regionali esistenti, avendo adottato un modello che utilizza le schede di dimissione ospedaliera (SDO) integrate da un minimum data set (MDS); tracciabilità del paziente tramite pseudonimo; tracciabilità del dispositivo (15). La legge istitutiva dell’RNPM (10) ha previsto l’organizzazione del Registro a livello regionale e a livello nazionale e, pertanto, il modello federativo e il network già sperimentati e avviati dal RIAP hanno rappresentato un utile riferimento per impostare l’organizzazione di tale Registro, apportando tuttavia specifici adattamenti. Per quanto riguarda la definizione del flusso informativo, è stata condotta dal Ministero della Salute un’analisi di contesto che ha confrontato i dati di vendita nazionali forniti dai distributori di protesi mammarie con il numero di interventi di chirurgia ricostruttiva registrati dal flusso delle SDO. Tale indagine ha evidenziato che il 67% degli interventi di impianto di protesi mammaria avveniva per finalità estetica, dunque in regime privato, non tracciabile dal flusso SDO; solo il 33% degli interventi aveva finalità ricostruttive e avveniva all’interno di strutture pubbliche o private accreditate, tracciabili con il flusso SDO. Pertanto, al fine di realizzare una puntuale mappatura sul territorio di tutte le protesi mammarie, è stato convenuto che fosse necessario non solo individuare metodi e flussi alternativi a quello basato sull’utilizzo delle SDO, ma anche rendere obbligatoria, per i distributori che mettono a disposizione sul mercato italiano tali protesi, la trasmissione mensile al Registro dei dati identificativi e delle caratteristiche tecniche di tutti dispositivi venduti, anche quando non impiantati. Inoltre, è stato condiviso che tali dati sarebbero stati archiviati in un database dedicato di dispositivi medici (DM) di interesse per il registro (Dizionario RNPM-DM). La trasmissione dati è dettagliata nel disciplinare tecnico del Regolamento dell’RNPM (16) e comprende dati identificativi della protesi, caratteristiche tecniche della stessa e identificazione della struttura o dell’utente che ha in carico la protesi.
Protezione dei dati personali
L’impalcatura privacy dello studio pilota, allestita per supportarne l’avvio in attesa dell’emanazione del Regolamento previsto dal DPCM 3 marzo 2017, è stata progettata con un approccio privacy by design secondo le disposizioni del Regolamento Europeo in materia di protezione dei dati personali (17), per garantirne la protezione sia dei pazienti sia degli stessi operatori sanitari che hanno accesso al sistema informatizzato. In attesa del trasferimento della raccolta dati sul Nuovo Sistema Informativo Sanitario (NSIS) del Ministero della Salute, i dati anagrafici dei pazienti vengono pseudonimizzati mediante l’applicazione di tecniche crittografiche sui dati identificativi, in accordo con quanto prescritto dal Decreto n. 262 del 7 dicembre 2016 (18). I pazienti possono essere rintracciati, in caso di necessità, attraverso la collaborazione dei chirurghi, operanti nei Centri dove è avvenuto l’intervento, che hanno aderito spontaneamente allo studio pilota. I chirurghi sono gli unici soggetti che possono re-identificare il paziente in caso di necessità. Per l’adesione dei chirurghi allo studio è stata predisposta una dichiarazione di impegno e assunzione di responsabilità, anche ai fini della tutela dei dati personali. Nell’attesa dell’approvazione del Regolamento, la raccolta dei dati clinici e demografici dei pazienti sottoposti a intervento è stata possibile con la somministrazione di un modulo di “Informazioni” e del relativo “Consenso Informato”, realizzati dal gruppo di lavoro ISS e approvati dal Responsabile della Protezione dei Dati Personali ISS. Il progetto ha ricevuto il parere favorevole del Comitato Etico dell'ISS.
Progettazione della piattaformaPOC-RNPM
La piattaforma POC-RNPM è stata progettata prendendo a riferimento la stessa architettura già definita per il RIAP e successivamente adottata per il RIPI (19, 20) che utilizza un modello di sicurezza basato sui ruoli. Secondo tale modello, gli utenti sono autorizzati ad accedere al sistema in base ai ruoli che ricoprono nella sanità pubblica o privata. Tali ruoli si dividono in due macroaree: ruoli amministrativo-gestionali e ruoli clinici, ciascuno dei quali si contestualizza sull’area di competenza dell’utente (ad esempio, il referente regionale di una Regione non può effettuare azioni amministrativo-gestionali relative a un’altra Regione; un chirurgo può registrare e visionare solo ed esclusivamente gli interventi delle strutture per le quali è stato accreditato).
A ogni ruolo è associato un livello e i livelli interagiscono secondo procedure di delega a cascata seguendo una definita piramide gerarchica (Figura 1). Gli operatori sanitari, che si trovano alla base della piramide, sono gli unici a poter inserire i dati clinici. Risalendo la piramide verso il vertice, aumentano sia la facoltà di delega di funzioni amministrativo-gestionali sia la possibilità di visionare e monitorare l’attività clinica svolta sul territorio di pertinenza del ruolo.
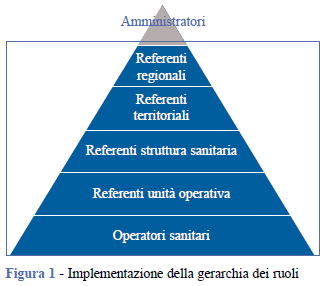
Regolamento
Nel corso della prima fase dello studio è stato definito anche lo schema di Regolamento attuativo dell’RNPM, richiesto dalla legge per rendere l’alimentazione del Registro obbligatoria e disciplinare accesso, operazioni e misure per la custodia e la sicurezza dei dati raccolti.
Risultati
Selezione delle variabili
Al termine del processo di selezione delle variabili è stato convenuto con le società scientifiche e con i distributori di dispositivi che il dataset avrebbe considerato 75 variabili che possono essere sintetizzate nei seguenti macrogruppi: 10 variabili per dati anagrafici del soggetto sottoposto a impianto o revisione di protesi mammaria, 6 variabili per dati identificativi della struttura presso cui è effettuato l’intervento e del chirurgo, 16 variabili per dati anamnestici del soggetto, 29 variabili per dati dell’intervento e 14 variabili relative ai dispositivi impiantati o rimossi. La sinossi delle variabili è riportata in dettaglio nel Disciplinare Tecnico (Allegato A) del Regolamento (16).
Flusso informativo dell’RNPM
Il flusso informativo dell’RNPM utilizzato nel corso della fase pilota è schematizzato nella Figura 2. I dati anagrafici, clinici e dei dispositivi impiantati o rimossi sono inseriti dai medici o dagli altri professionisti sanitari che prendono in cura il soggetto assistito e vanno ad alimentare il Registro nazionale. A regime, quando la piattaforma entrerà in produzione all’interno dell’NSIS, i dati inseriti dagli operatori sanitari alimenteranno i registri regionali che a loro volta alimenteranno il Registro nazionale, nel rispetto del modello federativo descritto dalla legge istitutiva dell’RNPM (10) e disciplinato dal relativo Regolamento (16). Per la selezione del dispositivo impiantato, l’operatore sanitario interroga direttamente il Dizionario RNPM-DM.
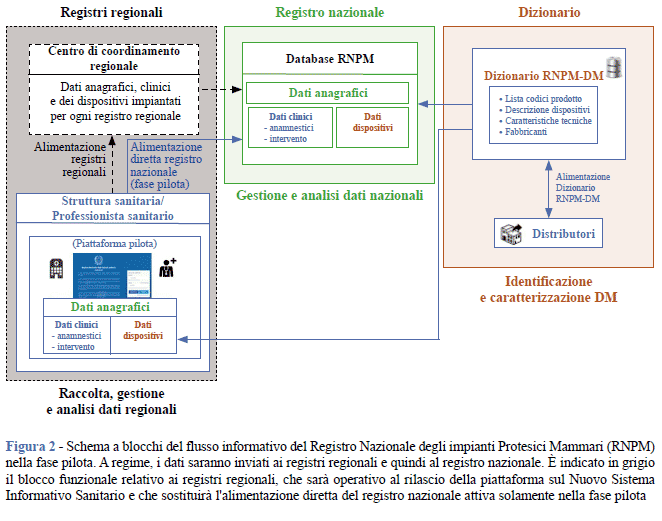
Realizzazione della piattaforma POC-RNPM
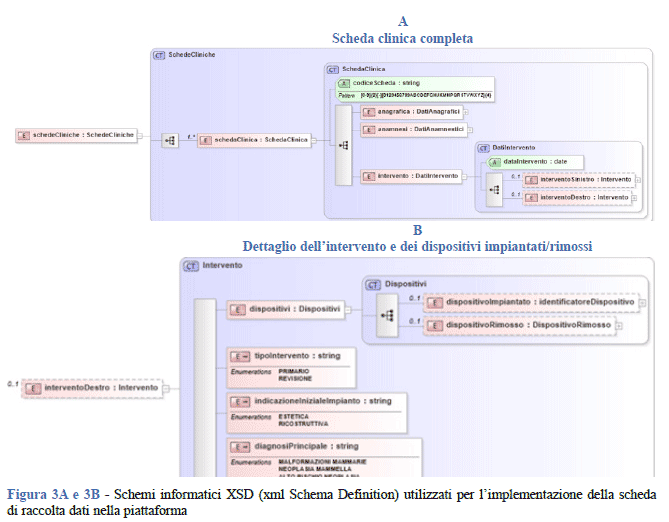
La piattaforma POC-RNPM è stata rilasciata il 25 marzo 2019. Per la raccolta dei dati di ciascun intervento è stata implementata una scheda clinica, schematizzata secondo un modello formale (eXtended Markup Language, XML) e contenente le informazioni incluse nel dataset. La Figura 3 riporta lo schema informatico XSD (XML Schema Definition) dell’intera scheda clinica (Figura 3A) e di un suo dettaglio per quanto riguarda le informazioni raccolte per l’intervento e per i dispositivi impiantati o rimossi (Figura 3B). La rappresentazione XSD permette di sintetizzare, secondo una struttura ad albero, le relazioni esistenti fra le 75 variabili incluse nella scheda di raccolta dati e qui aggregate per macrogruppi. Dal punto di vista dell’interoperabilità a livello nazionale, i modelli formali di cui sopra sono stati progettati con l’obiettivo di garantire una futura integrazione dei flussi dati di registro con i flussi di dati sanitari che costituiscono l’NSIS.
Formazione degli operatori e gestione degli accessi
Per assicurare una corretta raccolta dati nella fase pilota, è stato necessario formare i chirurghi al corretto utilizzo della piattaforma applicativa. Le società scientifiche coinvolte nel Tavolo di lavoro dedicato all’RNPM, istituito presso il Ministero della Salute, hanno fornito la lista dei chirurghi, distribuiti per Regione e Provincia Autonoma, disponibili a partecipare allo studio pilota. Tra i mesi di marzo e maggio 2019, sono state organizzate giornate formative e sono stati resi disponibili sulla piattaforma video esplicativi sul suo funzionamento e sulle modalità di registrazione dell’intervento. A ciascun chirurgo accreditato sulla piattaforma è stato chiesto di far pervenire osservazioni sulla facilità di utilizzo del sistema e sui contenuti della scheda di raccolta dati.
Analisi sui dati raccolti dal 2019
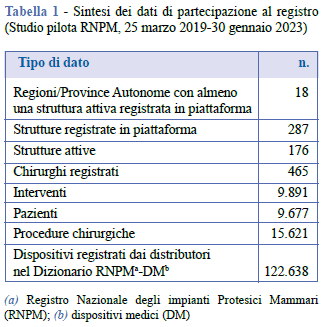
La Tabella 1 presenta il dettaglio dei principali risultati raggiunti in termini di partecipazione al Registro nel periodo intercorso tra il 25 marzo 2019, data di rilascio della piattaforma e di inizio della raccolta dati, e il 30 gennaio 2023. Le strutture sanitarie nelle quali i chirurghi hanno registrato gli interventi di impianto o rimozione di una protesi mammaria (strutture attive) sono 176 e appartengono a 18 Regioni. La differenza tra il numero di interventi chirurgici (9.891) e il numero di pazienti (9.677) è attribuibile al fatto che alcuni pazienti, seppure in un lasso di tempo relativamente breve, sono stati sottoposti a più interventi. Per procedura chirurgica si intende l’intervento effettuato su ogni singola mammella, sia esso di impianto o di rimozione di una protesi. Il maggior numero di procedure chirurgiche (15.621) rispetto al numero di interventi è dovuto agli interventi bilaterali (un intervento bilaterale consta di due procedure chirurgiche), frequenti soprattutto nell’ambito della chirurgia estetica. Mediamente, il 61,3% delle strutture sanitarie registrate nella piattaforma ha attivamente raccolto i dati (Tabella 2). In Figura 4 è mostrata la distribuzione su base mensile delle registrazioni degli interventi nel periodo di osservazione.
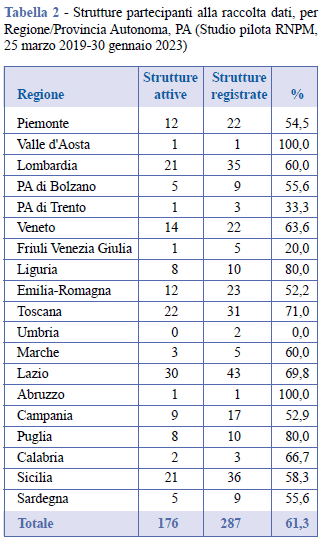
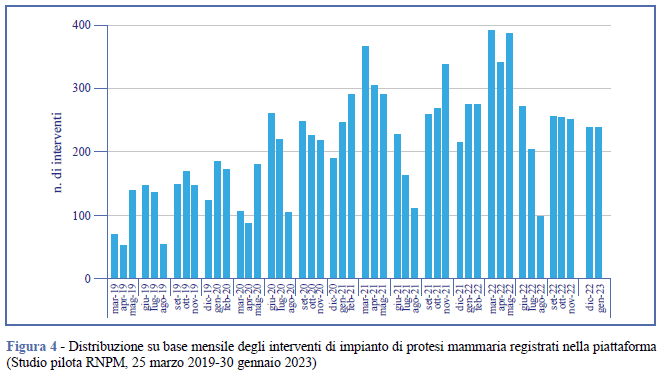
Dei 15.621 interventi registrati, il 44,7% è relativo alla chirurgia estetica, il restante 55,3% alla chirurgia ricostruttiva. In totale gli interventi di revisione sono circa 1/3 degli interventi primari (Tabella 3).
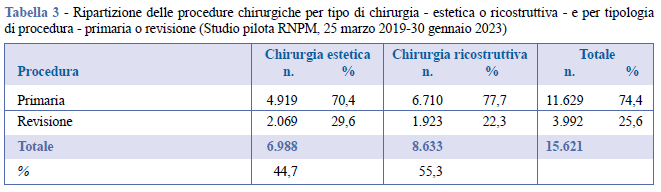
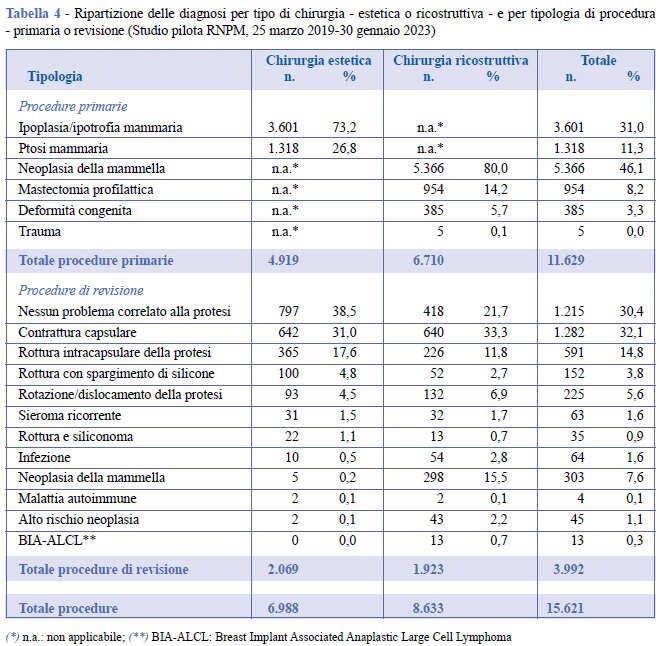
Le indicazioni dell’intervento chirurgico per finalità estetiche sono state l’ipoplasia/ipotrofia e la ptosi mammaria. Una neoplasia, una mastectomia profilattica, una deformità congenita o gli esiti di un trauma risultano le principali diagnosi associate agli interventi primari di chirurgia ricostruttiva. Per quanto concerne gli interventi di revisione, per la chirurgia estetica le principali diagnosi rilevate sono state: nessun problema correlato alla protesi, contrattura capsulare e rottura protesica intracapsulare; per la chirurgia ricostruttiva: contrattura capsulare, nessun problema correlato alla protesi e neoplasia mammaria (Tabella 4).
I chirurghi che hanno partecipato alla fase pilota hanno riferito di aver impiegato pochi minuti per compilare la scheda relativa alla registrazione dell’intervento, che pertanto si è rivelata agile e rapida. Le osservazioni avanzate sulla quantità di dati da rilevare, in relazione alla procedura chirurgica eseguita, sono state utilizzate per definire il disciplinare tecnico incluso nel Regolamento dell’RNPM (16).
Conclusioni
Il presente lavoro ha descritto il percorso seguito nella concezione, progettazione e costruzione di un Registro unico, a oggi, nel panorama internazionale.
Il Regolamento Europeo sui dispositivi medici (21) ha evidenziato l’importante ruolo dei registri nella tutela della salute dei pazienti. Gli interventi di impianto di una protesi mammaria sono in costante crescita e coinvolgono un numero sempre maggiore di pazienti di tutte le fasce di età. Per le autorità competenti e per gli operatori economici, le analisi comparative e i report annuali prodotti dai registri rappresentano una fonte attendibile per una attenta valutazione della performance e della sopravvivenza dei dispositivi impiantati. Grazie ai registri è possibile garantire la tracciabilità dei dispositivi impiantati e quindi, in caso di necessità, è possibile intervenire tempestivamente aumentando così il livello di sicurezza e protezione dei pazienti.
La progettazione dell’RNPM ha preso a riferimento quanto già implementato dall’ISS per la realizzazione del sistema di raccolta dati del RIAP. Di quest’ultimo, sono state mantenute l’organizzazione federativa e il sistema di identificazione del dispositivo impiantato, utilizzando i dati caricati dai distributori nel Dizionario RNPM-DM, mentre non si è potuto applicare il modello di raccolta dati basato sul flusso informativo delle SDO integrato da un MDS aggiuntivo. A supporto di tale scelta, sono stati dirimenti i risultati delle attività di sorveglianza del Ministero della Salute, da cui emergeva che il 67% degli interventi di impianto di protesi mammaria avveniva a fini estetici in strutture private senza che potesse essere tracciato dal flusso SDO. L’utilizzo di un modello basato sulle SDO non avrebbe quindi permesso di catturare la totalità degli interventi, caratteristica essenziale di questa tipologia di registri. Conseguentemente, l’elemento di riferimento per monitorare la completezza del Registro è diventato il dispositivo impiantato. Per ottenere una mappatura puntuale di tutti i dispositivi distribuiti e impiantati nel territorio nazionale è stato cruciale il coinvolgimento dei distributori, il cui costante lavoro di aggiornamento del Dizionario RNPM-DM è essenziale per il funzionamento del Registro. L’importante numero di protesi mammarie registrato dai distributori italiani nel periodo di osservazione evidenzia l’interesse e la rilevanza percepiti anche dall’industria.
La fase pilota di raccolta dati è iniziata il 25 marzo 2019 e si è conclusa ufficialmente il 31 agosto 2021. Una analisi dettagliata dei dati raccolti in quel periodo è riportata in un report dedicato (22). Tuttavia, poiché la piattaforma sviluppata nel corso della fase pilota resterà operativa per il periodo transitorio necessario alla sua migrazione all’interno dell’NSIS, si è voluto fornire una fotografia quanto più aggiornata possibile dell’andamento della raccolta dati estendendo le analisi ai dati raccolti fino al 30 gennaio 2023.
Le analisi condotte sui dati raccolti nel periodo di osservazione mostrano una marcata prevalenza della registrazione di interventi di chirurgia ricostruttiva. Tale dato, in controtendenza con la realtà nazionale descritta dall’indagine preliminare condotta dal Ministero della Salute in collaborazione con i distributori, è da imputarsi alla parzialità con cui a oggi vengono ancora raccolti i dati sul territorio nazionale. I risultati presentati, sebbene di interesse per il mondo scientifico di settore, non sono ancora rappresentativi degli interventi di chirurgia protesica mammaria realizzati in Italia. Essi mostrano tuttavia il potenziale che questo Registro avrà nel prossimo futuro nel migliorare la conoscenza dell’utilizzo delle protesi mammarie a favore di un miglioramento della sicurezza dei pazienti (23).
La bassa completezza della raccolta dati rappresenta attualmente il limite alla piena operatività del Registro. Il problema dei bassi tassi di registrazione dovuti alla partecipazione volontaria verrà superato nel momento in cui quanto disposto dal Regolamento, entrato in vigore il 2 febbraio 2023 (16), verrà reso operativo non solo a livello centrale ma anche a livello regionale e territoriale. Infatti, grazie a tale provvedimento, predisposto dal Ministero della Salute con la collaborazione dell’ISS e approvato da parte del Garante, della Conferenza Stato-Regioni e, infine, del Consiglio di Stato, l’alimentazione dell’RNPM sarà resa obbligatoria e saranno disciplinati accessi, operazioni e misure per la custodia e la sicurezza dei dati. Sarà l’unico Registro nel mondo a essere istituito presso una autorità competente e a essere reso obbligatorio per legge. Si tratta di un importante passo verso l’organizzazione nel nostro Paese di un sistema di registri che permetta di monitorare la sicurezza dei dispositivi medici e di intervenire tempestivamente in caso di evento avverso a tutela della salute dei pazienti.
Ringraziamenti
Gli autori ringraziano i colleghi del Gruppo di Ricerca RIPI Mascia Masciocchi e Attanasio Cornacchia per il supporto fornito allo svolgimento dei progetti mirati alla realizzazione dello studio pilota del Registro Nazionale degli impianti Protesici Mammari; Rosaria Boldrini del Ministero della Salute che ha coordinato la prima fase dello studio pilota, identificando i requisiti che hanno portato alla progettazione di un sistema efficace.
Conflitti di interesse dichiarati: nessuno.
Finanziamenti: nessuno.
Comitato etico: Comitato etico dell'Istituto Superiore di Sanità, protocollo n. 13091 del 24 aprile 2019.
Authorship: tutti gli autori hanno contribuito in modo significativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- Ionescu P, Vibert F, Amé S, Mathelin C. New Data on the Epidemiology of Breast Implant- Associated Anaplastic Large Cell Lymphoma. Eur J Breast Health 2021;17(4):302-7. doi: 10.4274/ejbh. galenos.2021.2021-5-6. Erratum in: Eur J Breast Health 2021;18(1):107. PMID: 35059601
- International Society of Aesthetic Plastic Surgery. ISAPS International Survey on Aesthetic/Cosmetic Procedures performed in 2021. www.isaps.org/...; ultimo accesso 6/4/2023.
- American Society of Plastic Surgeons. Plastic Surgery Statistics Report. ASPS National Clearinghouse of Plastic Surgery Procedural Statistics. www.plasticsurgery.org/...; ultimo accesso 6/4/2023.
- Comunità Economica Europea. Direttiva 93/42/ CEE del 14 giugno 1993 concernente i dispositivi medici (Gazzetta ufficiale delle Comunità europee, L 169, 12 luglio 1993), attuata dal Decreto Legislativo n. 46 del 24 febbraio 1997 - Supplemento ordinario alla Gazzetta Ufficiale n. 54, 6 marzo 1997.
- International Medical Device Regulators Forum Patient Registries Working Group. Principles of International System of Registries Linked to Other Data Sources and Tools. IMDRF/REGISTRY WG/ N33FINAL:2016. 30 September 2016.
- Medicines and Healthcare products Regulatory Agency. All metal-on-metal (MoM) hip replacements. Medical Device Alert MDA/2010/033. 22 April 2010.
- Medicines and Healthcare products Regulatory Agency. DePuy ASR™ hip replacement implants. Medical Device Alert MDA/2010/069. 7 September 2010.
- Medicines and Healthcare products Regulatory Agency. All metal-on-metal (MoM) hip replacements. Medical Device Alert MDA/2012/008. 28 February 2012.
- European Commission. Press Release - Medical devices: European Commission calls for immediate actions - tighten controls, increase surveillance, restore confidence. 9 February 2012. europa.eu/...; ultimo accesso 6/4/2023.
- Italia. Legge del 5 giugno 2012, n. 86. Istituzione del registro nazionale e dei registri regionali degli impianti protesici mammari, obblighi informativi alle pazienti, nonché divieto di intervento di plastica mammaria alle persone minori. Gazzetta Ufficiale - Serie Generale n. 148, 27 giugno 2012.
- Italia. Decreto del Presidente del Consiglio dei Ministri del 3 marzo 2017. Identificazione dei sistemi di sorveglianza e dei registri di mortalità, di tumori e di altre patologie. Gazzetta Ufficiale - Serie Generale n. 109, 12 maggio 2017.
- Campanale A, Boldrini R, Lispi L, Marletta M, Carrani E, Toccaceli V, et al. Box 1.10 Il RIAP come riferimento per l’avvio dello studio pilota del Registro Nazionale delle Protesi Mammarie. In: Torre M, Carrani E, Ceccarelli S, Biondi A, Masciocchi M, Cornacchia A (Ed.). Registro Italiano ArtroProtesi. Report Annuale 2019. Roma: Il Pensiero Scientifico Editore, 2020.
- Cooter RD, Barker S, Carroll SM, Evans GRD, von Fritschen U, Hoflehner H, et al. International importance of robust breast device registries. Plast Reconstr Surg 2015;135(2):330-6. doi: 10.1097/PRS.0000000000000885
- Spronk PER, Begum H, Vishwanath S, Crosbie A, Earnest A, Elder E, et al. Toward International Harmonization of Breast Implant Registries: International Collaboration of Breast Registry Activities Global Common Data Set. Plast Reconstr Surg 2020;146(2):255-67. doi: 10.1097/ PRS.0000000000006969
- Torre M, Ceccarelli S, Carrani E. Il Registro Italiano ArtroProtesi: uno strumento per potenziare la sicurezza dei pazienti. Not Ist Super Sanità 2019;32(10) - Inserto BEN:1-5.
- Italia. Decreto 19 ottobre 2022, n. 207. Regolamento recante istituzione del registro nazionale degli impianti protesici mammari. Gazzetta Ufficiale - Serie Generale n. 14, 18 marzo 2023.
- Unione Europea. Regolamento (UE) 2016/679 del Parlamento europeo e del Consiglio del 27 aprile 2016, relativo alla protezione delle persone fisiche con riguardo al trattamento dei dati personali, nonché alla libera circolazione di tali dati e che abroga la direttiva 95/46/CE. Gazzetta ufficiale dell'Unione europea L 119, 4 maggio 2016.
- Italia. Decreto 7 dicembre 2016, n. 262. Regolamento recante procedure per l'interconnessione a livello nazionale dei sistemi informativi su base individuale del Servizio sanitario nazionale, anche quando gestiti da diverse amministrazioni dello Stato. Gazzetta Ufficiale - Serie Generale n. 32, 8 febbraio 2017.
- Torre M, Carrani E, Franzò M, Ciminello E, Urakcheeva I, Bacocco DL, et al. Il Registro Italiano delle Protesi Impiantabili: una nuova realtà per la sicurezza del paziente. Boll Epidemiol Naz 2021;2(2):16-23. doi: 10.53225/BEN_015
- Bacocco DL, Carrani E, Ciciani B, Di Sanzo P, Leotta F, Torre M. Design and implementation of the new Italian healthcare digital interoperable registry for implantable medical devices. Softw Pract Exper 2022;52(11):2368-92. doi: 10.1002/spe.3130
- Unione Europea. Regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio. Gazzetta ufficiale dell'Unione europea L 117, 5 maggio 2017.
- Campanale A, Ventimiglia M, Minella D, Torre M, Carrani E, Iachino A, et al. Registro nazionale degli impianti protesici mammary - RNPM - Report “fase pilota” 2019-2021. Roma: Ministero della salute; 2022.
- Campanale A, Ventimiglia M, Minella D, Sampaolo L, Iachino A, Lispi L. National Breast Implant Registry in Italy. Competent authority perspective to improve patients’ safety. PRRS 2022;1:34-45. doi: https://doi.org/10.57604/PRRS-005; ultimo accesso 6/4/2023.

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale