Relazione tra anticipazione diagnostica e terapie: confronto fra cancri della mammella in donne sottoposte e non a screening
Pamela Mancuso1, Massimo Vicentini1, Francesca Ferrari1, Annamaria Pezzarossi1, Moira Ragazzi2, Stefania Caroli3, Moira Foroni2, Alberto Cavazza2, Simonetta Piana2, Cinzia Campari3, Lucia Mangone1, Giancarlo Bisagni4 e Paolo Giorgi Rossi1
1Servizio di Epidemiologia, AUSL IRCCS Reggio Emilia;
2Servizio di Anatomia Patologica, AUSL IRCCS Reggio Emilia;
3Centro di Coordinamento Screening, AUSL IRCCS Reggio Emilia;
4Dipartimento di Oncologia, AUSL IRCCS Reggio Emilia
SUMMARY (Relation between early diagnosis and therapies: comparison of breast cancers in screened and non-screened women) - To assess whether radiotherapy, chemotherapy and hormone therapy use is different in screened and non-screened women with breast cancer, 366 cases aged 45-76 years diagnosed in 2013 were selected. Women were classified as screened (i.e., a mammogram in the 36 months prior to diagnosis) or non-screened, regardless of test result. Information on women’s screening history and therapy was collected. Cancers were classified according to stage and immunophenotype: Luminal-A, Luminal-B (HER2+, Her2-), Her2+non-Luminal, triple-negative. Women’s odds ratio were computed for each therapy. 112 cancers underwent chemotherapy, 260 radiotherapy, 40 target-therapy, and 286 hormone therapy. Chemotherapy and target-therapy use were lower in screened compared to non-screened women (OR: 0.56; IC 95%: 0.31;0.98 and OR:0.63; IC 95%: 0.28;1.14, respectively), while hormone and radiotherapy were more used in screened patients (OR:1.68; IC 95%: 0.88;3.21 and OR: 1.62; IC 95%: 0.89; 2.94, respectively). Immunophenotype did not differ between screened and non-screened (χ2 = 1.80; p = 0.77), while stage did (χ2 = 24.28; p = 0.00). Screening reduced burden of chemotherapy and target-therapy, perhaps due to the more favorable stage distribution, while hormone and radiotherapy prescriptions are increasing. No differences between screened and non-screened women were observed in case of immunophenotype therapy.
Key words: breast cancer; screening; therapies
Introduzione
I tumori della mammella screen-detected mostrano una prognosi più favorevole, in media, rispetto ai cancri sintomatici, grazie a uno stadio più precoce alla diagnosi e a un grading più differenziato (1, 2). I cancri intervallo hanno più probabilità di essere di alto grado o di avere i recettori per gli estrogeni negativi (3) rispetto ai tumori individuati con lo screening. L’amplificazione del gene HER2 è stata associata, in modo variabile, a tumori clinicamente sintomatici, ma i risultati sono incoerenti (4-6). La proporzione di tumori con grading scarsamente differenziato è minore nei casi screen-detected e si ritiene attribuibile alla capacità dello screening di rilevare lesioni indolenti o comunque ben differenziate e con un tempo di crescita molto lungo (7). Non è ancora chiaro però quale sia la capacità dello screening di prevenire l’incidenza di tumori con fenotipi più aggressivi attraverso l’anticipazione diagnostica. Anche aggiustando per stadio, rimangono differenze di sopravvivenza tra tumori screen-detected e non, che possono essere dovute ad altri fattori prognostici, come l’immunofenotipo oppure al miglioramento delle terapie e della loro appropriatezza prescrittiva. Infine, i cancri screen-detected hanno una prognosi migliore rispetto a quelli sintomatici, anche quando si aggiusta per altre variabili prognostiche (dimensione, stato linfonodale, grado istologico e recettori ormonali) (8).
In questo studio si è cercato di valutare, in un’area dove il programma di screening è attivo da circa 20 anni, le prescrizioni di terapie mediche e radioterapiche in base alla storia individuale di screening: popolazione screenata (S), popolazione non screenata (NS), considerando lo stadio e l’immunofenotipo al momento della diagnosi.
Metodi
Sono state estratte casualmente, dal Registro Tumori Reggiano, 500 donne con tumore della mammella incidente nel 2013 e selezionate 366 di età 45-76 anni. Per questi casi sono state raccolte informazioni su stato di screening, stadio, recettori ormonali, Ki67, HER2 e terapie prescritte (chemioterapia, ormonoterapia, radioterapia e target-therapy).
Le donne sono state classificate in base alla storia individuale di screening in NS, donne senza un test di screening nei 36 mesi precedenti alla diagnosi, ed S, donne con almeno un test di screening nei 36 mesi precedenti la diagnosi. Queste ultime comprendono screen-detected, cancri diagnosticati durante i test di screening, e cancri intervallo, cioè cancri diagnosticati tra un test negativo e il successivo. I cancri intervallo sono stati definiti come cancri con un test di screening negativo nei 18 mesi antecedenti la diagnosi per la fascia 45-49 anni e 36 mesi per la fascia 50-76 anni. I tumori sono stati classificati in base allo stadio e all’immunofenotipo: Luminal-A (ER+, PR+, Ki67<20, HER2-), Luminal B- (ER+, PR+, Ki67≥20, HER2-), Luminal B+ (ER+, PR+, Ki67 qualsiasi, HER2+), HER2+- non-Luminal (ER-, PR-, HER2+), triple-negative (ER-, PR-, HER2-).
Attraverso dei modelli logistici aggiustati per età sono stati calcolati gli odds ratio (OR) di ricevere ciascuna terapia nelle donne S e in quelle NS.
Risultati
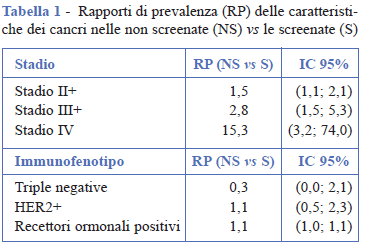
Delle 366 donne selezionate, 306 sono S e 60 NS. L’età media nelle S era di 60 anni (range 45-76) e nelle NS di 61 (range 45-76). Le classi immunofenotipiche non differiscono tra S e NS (Χ² = 1,80; p = 0,77), mentre lo stadio è diverso nei due gruppi (Χ² = 24,3; p = 0,00) (in situ e stadio I 69,6% S vs 56,7% NS, stadio IV 0,7% S vs 10% NS). Tra i cancri la proporzione di stadio II+ in chi non ha fatto screening è 1,5 volte maggiore rispetto alle S, per lo stadio III+ di 2,8 e per lo stadio IV di 15,3. La proporzione di triple negative nelle NS è 0,3 rispetto alle S, anche se la differenza non è significativa (IC 95%: 0,0;2,1). La proporzione di HER2+ nelle NS è 1,1 rispetto alle S, e di 1,1 per i recettori ormonali positivi (estrogeni e progesteroni positivi) (Tabella 1).
Sono state sottoposte a chemioterapia 112 donne (S: 87, NS: 25), 260 a radioterapia (S: 223, NS: 37), 40 a target-therapy (S: 31, NS: 9) e 286 a ormonoterapia (S: 244, NS: 42) (Tabella 2).
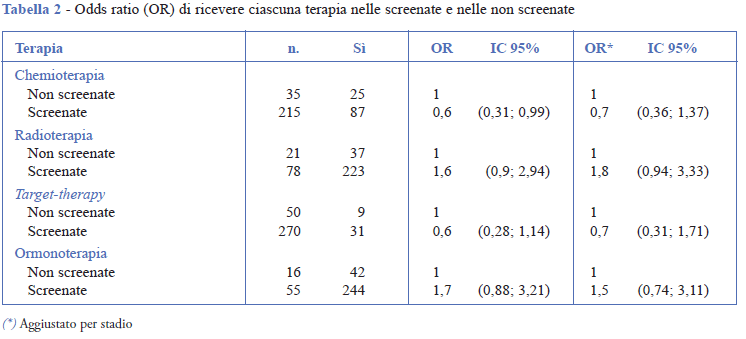
Le donne S ricevono meno chemioterapia (OR: 0,56; IC 95%: 0,31;0,98) e meno targettherapy (OR: 0,63; IC 95%: 0,28; 1,14), ma più ormonoterapia (OR: 1,68; IC 95%:0,88; 3,21) e radioterapia (OR: 1,62; IC 95%: 0,89; 2,94), anche se alcune di queste differenze sono compatibili con fluttuazioni casuali. Aggiustando per stadio i risultati sono simili per radio e target therapy, mentre si riducono lievemente le differenze per chemioterapia (OR: 0,70; IC 95%: 0,36; 1,37) e ormonoterapia (OR: 1,52; IC 95%: 0,74; 3,11) tra S e NS (Tabella 2).
Conclusioni
Lo stadio, come atteso, mostra una distribuzione nettamente più favorevole nelle donne che partecipano allo screening, le quali hanno cancri in stadi più precoci; tuttavia l’anticipazione diagnostica non sembra modificare l’immunofenotipo, almeno per quanto la potenza statistica di questo campione permetta di valutare.
Le S hanno anche una minor pressione terapeutica rispetto alle NS; in particolare si riducono chemioterapia e target-therapy, mentre aumentano lievemente le prescrizioni di ormono e radioterapia. Le donne S fanno meno chemio e target-therapy coerentemente con la maggiore prevalenza di stadi I. La radioterapia è più frequente nelle S, coerentemente con quanto raccomandato dalle linee guida per gli stadi più precoci (9). I modelli multivariati mostrano però che questi risultati sono spiegati solo in parte dalla distribuzione più favorevole dello stadio alla diagnosi nelle donne S e non può essere spiegato da un miglior immunofenotipo. In particolare, è inaspettato il maggior ricorso a ormonoterapia nelle donne S a parità di stato recettoriale. Le differenze nelle terapie potrebbero essere dovute a un confondimento residuo, cioè lo stadio è una misura troppo grossolana della gravità della malattia. Un’altra ipotesi è che il processo decisionale sul piano terapeutico, per le donne S, segua un percorso più multidisciplinare che porta a decisioni terapeutiche differenti.
Dichiarazione sui conflitti di interesse
Gli autori dichiarano che non esiste alcun potenziale conflitto di interesse o alcuna relazione di natura finanziaria o personale con persone o con organizzazioni che possano influenzare in modo inappropriato lo svolgimento e i risultati di questo lavoro.
Riferimenti bibliografici
1. Paci E, Ponti A, Zappa M, et al. Early diagnosis, not differential treatment, explains better survival in service screening. Eur J Cancer 2005;41(17):2728-34.
2. Buiatti E, Barchielli A, Bartolacci S, et al. The impact of organised screening programmes on the stage-specific incidence of breast cancer in some Italian areas. Eur J Cancer 2003;39(12):1776-82.
3. José Bento M, Gonçalves G, Aguiar A, et al.Clinicopathological differences between interval and screen-detected breast cancers diagnosed within a screening programme in Northern Portugal. J Med Screen 2014;21(2):104-9.
4. Sihto H, Lundin J, Lundin M, et al. Breast cancer biological subtypes and protein expression predict for the preferential distant metastasis sites: a nationwide cohort study. Breast Cancer Res 201;13(5):R87.
5. Sihto H, Lundin J, Lehtimäki T, et al.Molecular subtypes of breast cancers detected in mammography screening and outside of screening. Clin Cancer Res 2008;14(13):4103-10.
6. Pálka I, Kelemen G, Ormándi K, et al. Tumor characteristics in screen-detected and symptomatic breast cancers. Pathol Oncol Res 2008;14(2):161-7.
7. Coburn NG, Cady B, Fulton JP, et al. Improving size, lymph node metastatic rate, breast conservation, and mortality of invasive breast cancer in Rhode Island women, a well-screened population. Breast Cancer Res Treat 2012;135(3):831-7.
8. Lehtimäki T, Lundin M, Linder N, et al. Long-term prognosis of breast cancer detected by mammography screening or other methods. Breast Cancer Res 2011;13(6):R134.
9. Breast Cancer Care. Radiotherapy for primary breast cancer.

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale