Il Registro Italiano ArtroProtesi: uno strumento per potenziare la sicurezza dei pazienti*
Marina Torre, Stefania Ceccarelli, Eugenio Carrani
Segreteria Scientifica della Presidenza, Istituto Superiore di Sanità, Roma
SUMMARY (The Italian Arthroplasty Registry: a tool to enhance patient safety) - The EU Regulation on medical devices 2017/745 states that Member States shall take all appropriate measures to encourage the establishment of registers for specific types of devices to contribute to their traceability and to the independent evaluation of their long-term safety and performance. In Italy, in 2006, the Ministry of Health appointed the Italian National Institute of Health to study the flow to monitor outcomes of hip replacements: it was the beginning of the Italian Registry of Arthroplasty. Organised as a federation of regional registries coordinated by the Italian National Institute of Health, the Italian Arthroplasty Registry is currently a large collaborative network involving regions, surgeons, manufacturers and patients. Quality and completeness are essential requirements for medical device registries. In 2017, in Italy, the National Registry of Implanted Devices was established by law. To achieve high level of completeness, the participation of all the Italian regions is crucial.
Key words: registries; arthroplasty replacement; prostheses and implants
Introduzione
L’International Medical Device Regulatory Forum (IMDRF) definisce un registro di dispositivi medici come un “sistema organizzato con l'obiettivo primario di aumentare le conoscenze sui dispositivi medici contribuendo a migliorare la qualità della cura del paziente. Tale sistema raccoglie continuamente dati di interesse, valuta risultati significativi e copre in modo completo la popolazione definita dall'esposizione a particolari dispositivi su scala ragionevolmente generalizzabile (ad es. sistema sanitario internazionale, nazionale, regionale)" (1). Il nuovo Regolamento Europeo sui dispositivi medici dedica ai registri uno specifico articolo (art. 108), secondo il quale “la Commissione e gli Stati membri adottano tutte le misure opportune per incoraggiare l'istituzione di registri e banche dati di tipologie specifiche di dispositivi stabilendo principi comuni per la raccolta di informazioni comparabili. Tali registri e banche dati contribuiscono alla valutazione indipendente della sicurezza e della prestazione a lungo termine dei dispositivi o alla tracciabilità dei dispositivi impiantabili, oppure a tutte queste caratteristiche” (2), riconoscendo ai registri di dispositivi impiantabili il ruolo di strumenti essenziali per le attività di vigilanza e di sorveglianza post market.
Attraverso i registri è possibile misurare l’efficacia dei dispositivi in termini di sopravvivenza e richiamare tempestivamente i pazienti in caso di segnalazione di evento avverso. Inoltre, è dimostrato che i risultati prodotti dai registri guidano i chirurghi a scegliere protesi più performanti, migliorando così le pratiche cliniche, supportano le decisioni di amministratori, clinici e pazienti, in quanto forniscono dati sugli esiti a lungo termine e sul rapporto costo-efficacia degli impianti (3). I registri, inoltre, fungono da sentinella, allertando sui fallimenti precoci e sul potenziale danno per i pazienti (4); permettono, infine, di evitare interventi inutili e potenzialmente dannosi per i pazienti ed economicamente gravosi per la sanità (5).
Nel 2006, la Direzione Generale dei Farmaci e Dispositivi Medici (DGDMF) del Ministero della Salute ha incaricato l’Istituto Superiore di Sanità (ISS) di studiare un possibile flusso per implementare, su scala nazionale, la raccolta dei dati degli interventi di protesi di anca, il primo nucleo di quello che poi è diventato il Registro Italiano ArtroProtesi (RIAP). La richiesta è stata formulata in un momento in cui iniziava a svilupparsi, non solo in Italia, un interesse per avviare raccolte sistematiche di dati sugli interventi di sostituzione protesica articolare, visti importanti risultati e ricadute, in termini di qualità delle cure, legati alle attività svolte dai primi registri organizzati nei Paesi scandinavi fin dagli anni Settanta. Una scelta lungimirante che ha permesso, negli anni, di mettere a punto un sistema in grado di rispondere, anche nel nostro Paese, a quanto richiesto a livello europeo.
Obiettivo di questo lavoro è descrivere la storia del RIAP, la sua organizzazione e le prospettive future.
RIAP: dallo studio del flusso dati a una rete per la tracciabilità e la valutazione di efficacia delle protesi ortopediche
Nel maggio 2004, per la prima volta, referenti del Ministero della Salute, delle regioni e delle società scientifiche si sono riuniti in ISS per parlare della realizzazione di un registro nazionale degli interventi di protesi di anca. In quell’incontro sono stati definiti i pilastri dell’architettura del Registro: una federazione di registri regionali che utilizzava la scheda di dimissione ospedaliera (SDO), integrata da un set minimo di informazioni aggiuntive (minimum data set, MDS), per capitalizzare i flussi informativi esistenti e minimizzare il carico di lavoro per gli operatori. Sono state, inoltre, condivise le future linee di indirizzo: i) partire dall’anca per poi estendere la raccolta dati alle altre protesi, ii) sollecitare gli organi politici ad adottare provvedimenti normativi che sancissero l’obbligatorietà della partecipazione al Registro iii) coinvolgere aziende produttrici e pazienti. Il risultato di queste prime attività (6) ha portato la DGDMF a incaricare l’ISS di studiare un modello di flusso per il registro nazionale degli interventi di protesi di anca, stimolando parallelamente la definizione di una norma che istituisse i registri degli impianti protesici. Negli anni, si sono succeduti una serie di studi che hanno messo a punto e verificato sul campo la metodologia per la raccolta dei dati (per anca, ginocchio, spalla e, più recentemente, caviglia), in una rete collaborativa sempre più ampia e fortemente interconnessa con gli altri flussi informativi già operativi nel Sistema Sanitario Nazionale (SSN). I protocolli per la raccolta dati sono stati discussi e condivisi in seno al Comitato Scientifico (CS) del RIAP, l’organo responsabile dello svolgimento delle attività tecnico- scientifiche a cui partecipano tutti gli attori: pazienti, istituzioni di sanità pubblica, chirurghi ortopedici, fabbricanti. I risultati del RIAP sono oggi tangibili: sono stati istituiti nuovi registri regionali (Provincia Autonoma di Bolzano, Regione Calabria, Regione Campania, Provincia Autonoma di Trento), oltre a quelli già operativi prima dell'avvio del progetto (Emilia-Romagna e Lombardia); in Puglia, una Delibera regionale del 2010 ha legato la registrazione dei dati alla retribuzione del DRG (diagnosis related group), facendo innalzare in un solo anno la completezza della registrazione dal 10%, su base volontaria, al 95% (7).
Il modello di flusso informativo
Il flusso di raccolta dei dati (Figura 1) è basato sulle SDO integrate dalle variabili aggiuntive dell'MDS selezionate dagli esperti del CS, dopo un attento confronto con le schede di raccolta dati sviluppate da altri registri simili a livello nazionale e internazionale. Un modello che funziona, in quanto gli interventi sono svolti, in grandissima parte, in strutture pubbliche o accreditate dall'SSN che, per ogni ricovero, compilano la SDO. Considerata la struttura federativa del Registro, il linkage tra SDO e MDS avviene a livello dei Centri di coordinamento territoriale che sono responsabili della trasmissione dei dati all’ISS. Fondamentale, per le finalità del Registro, è la puntuale identificazione del dispositivo impiantato. A tal fine, con la collaborazione delle aziende produttrici, il RIAP ha organizzato il Dizionario RIAP-DM (dispositivi medici), che contiene oltre 60.000 record e copre oltre il 90% dei dispositivi registrati. Per valutare in maniera comparativa l’efficacia di una protesi è necessario conoscerne le caratteristiche tecniche e organizzarle in maniera strutturata all’interno di un database. Tale esigenza è stata risolta dal National Joint Registry of England, Wales, Northern Ireland and the Isle of Man (NJR) che, in collaborazione con l’Endoprothesenregister Deutschland (EPRD), ha recentemente aggiornato e sviluppato il NJR-EPRD Component database (CDB), alimentato direttamente dalle aziende produttrici di protesi. Le potenzialità offerte da tale strumento hanno portato il RIAP a proporre al NJR una collaborazione per interconnettere il Dizionario RIAP-DM e il NJR-EPRD CDB, creando un unico database internazionale delle protesi ortopediche impiantate nel Regno Unito, in Germania e in Italia (8).
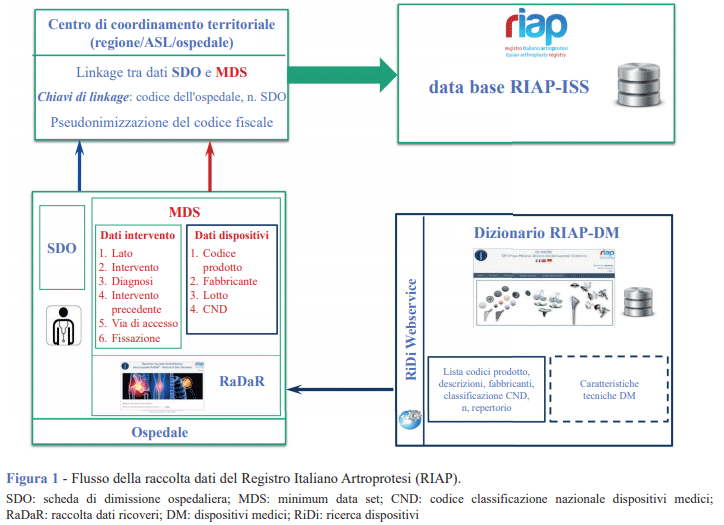
Completezza della registrazione e qualità dei dati: due elementi chiave per l’affidabilità del Registro
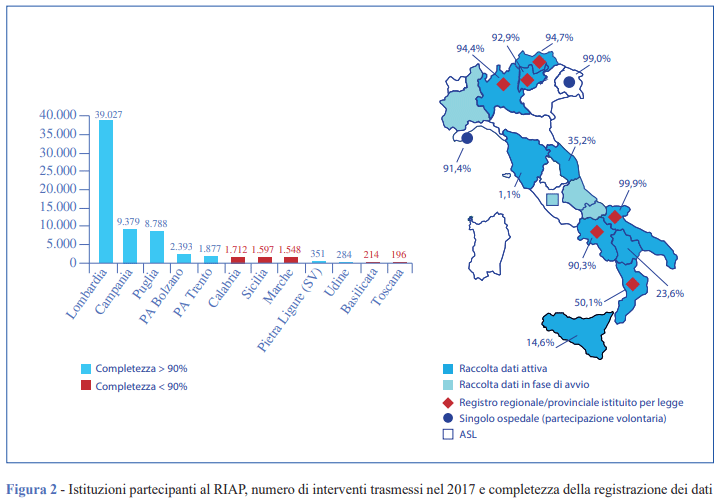
I risultati di un Registro sono affidabili solo se la completezza della registrazione è superiore al 90% e se la qualità dei dati è alta (9). Al RIAP partecipano 8 regioni, 2 province autonome e una serie di istituzioni. Il RIAP raccoglie il 35% degli interventi effettuati a livello nazionale, un dato dovuto alla natura volontaria della partecipazione e alla mancata adesione di regioni ad alto volume di attività. Nelle regioni partecipanti, la completezza media è pari a 65,6%. Alti livelli di completezza sono stati raggiunti nelle regioni che hanno reso obbligatoria la registrazione, in alcuni casi vincolando il pagamento della prestazione all’effettiva trasmissione del dato al Registro (Figura 2).
Dopo aver progettato il modello di flusso, sviluppato il sistema, avviato la raccolta dati ed esteso e consolidato la rete, è sembrato essenziale iniziare a lavorare sulla qualità dei dati raccolti. Per tale motivo, dal 2016, tutti i dati che confluiscono nel Registro sono sottoposti a un rigoroso controllo sia sintattico che semantico, secondo un protocollo condiviso e approvato dal CS. A seguito di tale controllo, tutti i partecipanti al RIAP ricevono un report dettagliato che permette loro di verificare le informazioni inserite nel Registro e, se necessario, correggerle (10).
Conclusioni
Anche in Italia, come nel resto del mondo, il numero di impianti di protesi ortopedica è destinato a crescere, e con essi il numero dei probabili interventi di revisione. L’impatto sulla spesa sanitaria sarà importante e quindi limitare il numero delle procedure di revisione diventa un obiettivo prioritario. L’attività dei registri può garantire che solo le pratiche e le tecnologie migliori, basate su solide evidenze scientifiche, riescano ad affermarsi (3). A partire dal 2006 il legislatore ha posto l’attenzione sulla necessità di formalizzare l’organizzazione dei sistemi di sorveglianza e dei registri. Un iter lungo e complesso ha portato alla pubblicazione del DPCM 3 marzo 2017 (11) che ha istituito, tra gli altri, presso l’ISS il Registro nazionale delle Protesi Impiantabili (RIPI), che ingloba il RIAP, e per il quale è stata resa obbligatoria l’alimentazione (12). Obiettivo del RIPI è quello di estendere ad altri dispositivi di impatto elevato sulla sanità pubblica, in termini di salute del paziente e spesa sanitaria, l’esperienza maturata dal RIAP, così come sta avvenendo per il Registro nazionale delle protesi mammarie, istituito presso il Ministero della Salute (13). Affinché anche il nostro Paese disponga di un sistema che monitori la qualità dei dispositivi impiantati a tutela della sicurezza dei pazienti, è necessario che tutte le regioni si muovano in questa direzione, ottemperando agli obblighi dettati dalla legge (11, 12, 14).
Con il pieno funzionamento del RIPI, si potranno evidenziare rapidamente i dispositivi che presentino comportamenti inferiori all’atteso, monitorare la mobilità interregionale e rintracciare tempestivamente i pazienti a cui sia stata impiantata una protesi oggetto di richiamo dal mercato.
Dichiarazione sui conflitti di interesse
Gli autori dichiarano che non esiste alcun potenziale conflitto di interesse o alcuna relazione di natura finanziaria o personale con persone o con organizzazioni che possano influenzare in modo inappropriato lo svolgimento e i risultati di questo lavoro.
Riferimenti bibliografici
- International Medical Devices Regulators Forum. Methodological Principles in the Use of International Medical Device Registry Data (IMDRF/Registry WG/ N42FINAL:2017).
- Europa. Regolamento (UE) 2017/745 del Parlamento Europeo e del Consiglio del 5 aprile 2017, relativo ai dispositivi medici, che modifica la Direttiva 2001/83/ CE, il Regolamento (CE) n. 178/2002 e il Regolamento (CE) n. 1223/2009 e che abroga le Direttive 90/385/CEE e 93/42/CEE del Consiglio. Gazzetta ufficiale dell’Unione Europea L117, 5 maggio 2017.
- Paxton EW, Inacio MCS, Kiley ML. The Kaiser Permanente implant registries: effect on patient safety, quality improvement, cost effectiveness, and research opportunities. Perm J 2012;16(2):36-44.
- von Knoch F, Marchie A, Malchau H. Total joint registries: a foundation for evidence-based arthroplasty. Virtual Mentor 2010;12(2):124-9.
- Sabah SA, Moon JC, Jenkins-Jones S, et al. The risk of cardiac failure following metal-on-metal hip arthroplasty. Bone Joint J 2018;100-B(1):20-7.
- Torre M (Ed.). Progetto per l’istituzione del Registro nazionale degli interventi di protesi di anca. Roma: Istituto Superiore di Sanità; 2005. (Rapporti ISTISAN 05/18).
- Balducci MT, Mudoni S, Meggiolini P, Parisi D, Germinario C. Regione Puglia. Dalla partecipazione volontaria all’obbligatorietà della registrazione e alla standardizzazione del dato. In: Torre M. (Ed.). Progetto Registro Italiano Artroprotesi. Secondo Report. Verso l’operatività. Roma: Il Pensiero Scientifico Editore; 2015.
- Torre M, Carrani E, Luzi I, et al. Strumenti per identificare e caratterizzare i dispositivi impiantabili: la prospettiva della collaborazione tra IL RIAP e il NJR. Not Ist Super Sanità 2018;31(4-5):11-4.
- Kolling C, Simmen BR, Labek G, et al. Key factors for a successful National Arthroplasty Register. J Bone Joint Surg Br 2007;89(12):1567-73.
- Torre M, Carrani E, Luzi I, Ceccarelli S, Laricchiuta P (Ed.). Registro Italiano ArtroProtesi. Report Annuale 2018. Roma: Il Pensiero Scientifico Editore; 2018.
- Italia. Decreto del Presidente del Consiglio dei Ministri 3 marzo 2017. Identificazione dei sistemi di sorveglianza e dei registri di mortalità, di tumori e di altre patologie. Gazzetta Ufficiale - Serie Generale n. 109, 12 maggio 2017.
- Italia. Legge 30 dicembre 2018, n. 145. Bilancio di previsione dello Stato per l’anno finanziario 2019 e bilancio pluriennale per il triennio 2019-2021 Comma 558. Gazzetta Ufficiale - Serie Generale n. 302, 31 dicembre 2018 - Suppl. Ordinario n. 62/L.
- Italia. Legge 5 giugno 2012, n. 86. Istituzione del registro nazionale e dei registri regionali degli impianti protesici mammari, obblighi informativi alle pazienti, nonché divieto di intervento di plastica mammaria alle persone minori. Gazzetta Ufficiale - Serie Generale n. 148, 27 giugno 2012.
- Italia. Legge 22 marzo 2019, n. 29 Istituzione e disciplina della Rete nazionale dei registri dei tumori e dei sistemi di sorveglianza e del referto epidemiologico per il controllo sanitario della popolazione Art. 5 Conferimento dei dati. Gazzetta Ufficiale - Serie Generale n. 81 del 5 aprile 2019.
Ringraziamenti
Mascia Masciocchi, Ilaria Luzi, Virgilia Toccaceli, Gabriella Martelli, Fabio Galati, il Gruppo di Lavoro RIAP, i membri del Comitato Scientifico RIAP, i chirurghi e gli operatori impegnati nella raccolta e trasmissione dei dati e tutti coloro che, nelle varie istituzioni, hanno contribuito allo sviluppo del Registro.
(*) Il progetto è stato realizzato grazie al contributo assicurato dal Ministero della Salute, Direzione Generale dei Dispositivi Medici e del Servizio Farmaceutico.

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale