Sistema di sorveglianza ospedaliera per la stima dell’incidenza della pertosse nei bambini sotto l'anno di età: risultati di uno studio osservazionale nella regione Lazio (2018)
Elisabetta Pandolfi¹, Luisa Russo¹, Ilaria Campagna¹, Caterina Rizzo¹, Emanuela Carloni¹, Carlo Concato², Giulia Linardos², Sara Ciampini¹ e Alberto Eugenio Tozzi¹
¹Area di ricerca Malattie Multifattoriali e Malattie Complesse, Ospedale Pediatrico Bambino Gesù, IRCSS, Roma; ²Unità di Virologia, Ospedale Pediatrico Bambino Gesù, IRCSS, Roma
SUMMARY (Hospital based surveillance system to assess the burden of whooping cough in infants: results from an observational active surveillance study in Lazio Region, 2018) - Due to heterogeneous clinical manifestations, to waning protection induced by pertussis vaccines over time and low vaccination coverage in adults, pertussis continues to circulate worldwide with epidemic outbreaks. Taking into account the recrudescence of the disease, in 2016, we conducted an active surveillance of hospitalized pertussis children, with the aim of measuring the burden of pertussis in children under 12 months. This is a prospective observational study in which all children under one year of age, presenting to the emergency department with symptoms compatible with pertussis, undergone a nasopharyngeal aspirate and RT-PCR (real time polymerase chain reaction) for diagnosis. From January to December 2018, 82 patients were enrolled; 29 tested positive for pertussis. The mean age was 2.6 months for positive cases and 2.7 months for negative cases (p-value < 0.001). Among all cases, 18 (62%) presented coinfection with at least another virus. We estimated a 36% adjusted vaccine effectiveness in the first year of life. The national surveillance system, based on mandatory notification, still underestimates the burden of disease. Taking into account that severe cases of pertussis occur mainly in children too young to be vaccinated, or partially immunized with low vaccine effectiveness, immunization of pregnant women remains a mainstay of prevention of the disease.
Key words: respiratory tract infections; Bordetella pertussis; sentinel surveillance
Introduzione
Negli ultimi dieci anni la pertosse è riemersa in molti Paesi europei (1). Dal 2011, il numero di casi di pertosse segnalati all'European Centre for Disease Prevention and Control (ECDC) è in aumento, con 42.242 casi di pertosse riportati in 29 regioni europee nel 2017, di cui 38.777 (92%) classificati come confermati (1). L’Italia è considerata a bassa incidenza, con un numero di casi in aumento dal 2013 al 2017 e un’incidenza che è passata da 0,9 a 1,6 per 100.000 abitanti (1). L'incidenza più alta è stata osservata tra gli adolescenti, gli adulti e in particolare tra i bambini troppo piccoli per essere vaccinati.
La riemergenza della pertosse nei Paesi con alta copertura vaccinale potrebbe essere attribuita a diversi fattori, tra cui un aumento dell'incidenza legato al calo della protezione indotta dai vaccini acellulari (2, 3), la disponibilità di migliori metodi diagnostici e una maggiore consapevolezza della malattia. Di conseguenza, un ruolo determinante nella circolazione della Bordetella pertussis lo giocano le infezioni subcliniche, spesso non diagnosticate, negli adolescenti e negli adulti e le infezioni più severe nei bambini che non hanno concluso il percorso vaccinale di età inferiore a un anno (1-4).
In Italia, la pertosse ha continuato a circolare con cicli epidemici regolari, nonostante i cambiamenti demografici e anche dopo l'introduzione della vaccinazione. L’immunità, sia essa da vaccino che da infezione naturale, diminuisce negli anni, con perdita della protezione nei confronti della malattia (3-5). Lo spostamento in avanti dell’età di infezione comporta una grossa fetta di mancate diagnosi. I sintomi della pertosse, infatti, negli adolescenti, negli adulti e negli individui precedentemente vaccinati, non sono sempre così specifici come nei bambini (6, 7).
In Italia la notifica di infezione da Bordetella pertussis si basa principalmente su una diagnosi clinica, pur essendo disponibili test di laboratorio per la diagnosi dell’infezione (6). La sorveglianza epidemiologica in atto nella maggior parte dei Paesi europei sottostima l’impatto reale della malattia, a causa della sua manifestazione clinica atipica in soggetti vaccinati, la potenziale coinfezione con virus respiratori e l'accesso non ottimale alla diagnosi di laboratorio tramite RTPCR - real time polymerase chain reaction (6, 8). Con lo scopo di potenziare la diagnosi molecolare dei casi di pertosse e di ridurre il gap con l’attuale sistema di sorveglianza basato solo sui sintomi clinici, l’Ospedale Pediatrico Bambino Gesù ha istituito un sistema di sorveglianza attiva ospedaliera, nell’ambito di un progetto europeo finanziato dall'ECDC.
Materiali e metodi
Lo studio di sorveglianza attiva dell’infezione da Bordetella pertussis è stato condotto su una popolazione di bambini di età inferiore ai 12 mesi afferenti all’Ospedale Pediatrico Bambino Gesù e al Dipartimento di Pediatria dell’Azienda Ospedaliera Universitaria Policlinico Umberto I, entrambi di Roma, volto a stimare l’impatto della pertosse in questo gruppo di popolazione.
Tutti i pazienti che sono arrivati al dipartimento di emergenza e accettazione (DEA) dei due ospedali tra gennaio e dicembre 2018, con sintomi compatibili con infezione da Bordetella pertussis, secondo il criterio clinico della definizione di caso dell’ECDC (9), sono stati sottoposti ad aspirato nasofaringeo; su tale test è stata effettuata una RT-PCR specifica per pertosse e per i seguenti virus respiratori: virus influenza A e B, virus respiratorio sinciziale A e B, coronavirus 229E, OC43, NL63, HKU1, virus parainfluenzale 1,2,3, rhinovirus A, B e C, adenovirus, metapneumovirus e bocavirus umano. Ai genitori o tutori dei pazienti reclutati è stato chiesto di firmare un consenso informato circa la possibilità di utilizzare i risultati della RT-PCR ai fini di ricerca e a coloro che hanno espresso il consenso a partecipare allo studio sono state richieste informazioni sociodemografiche e cliniche. Un caso di pertosse è stato definito come un bambino di età inferiore a un anno ricoverato in uno dei due ospedale partecipanti, indipendentemente dalla durata del ricovero, con diagnosi di laboratorio mediante RT-PCR effettuata su aspirato nasofaringeo o isolamento in coltura. Le proporzioni delle variabili categoriche sono state confrontate, nei due gruppi di bambini, con il test Χ² le medie delle variabili quantitative sono state confrontate con il t-test.
Innestato nella sorveglianza attiva, è stato condotto uno studio caso-controllo volto a stimare l’efficacia del vaccino nel prevenire i casi ospedalizzati di pertosse, dove, i casi erano rappresentati dai pazienti con pertosse confermata in laboratorio e i controlli da pazienti negativi alla pertosse. L’efficacia vaccinale (EV) è stata calcolata utilizzando la formula: EV = 1 − Odds Ratio. È stato inoltre calcolato l’intervallo di confidenza (IC) al 95% della stima puntuale dell’EV. Nel calcolo dell'EV sono stati inclusi solo i bambini eleggibili alla vaccinazione (età maggiore di 60 giorni); sono stati esclusi i bambini che hanno presentato un tempo superiore a 28 giorni tra l'insorgenza dei sintomi e l’esecuzione dell’aspirato nasofaringeo e sono stati considerati vaccinati solo i bambini che avevano ricevuto la dose di vaccino almeno 14 giorni prima dell'insorgenza dei sintomi. Per la stima dell’EV aggiustata, è stato utilizzato un modello di regressione logistica multivariata che includeva i potenziali fattori di confondimento e il cui valore di p-value, nell'analisi univariata, era risultato < 0,20.
Risultati
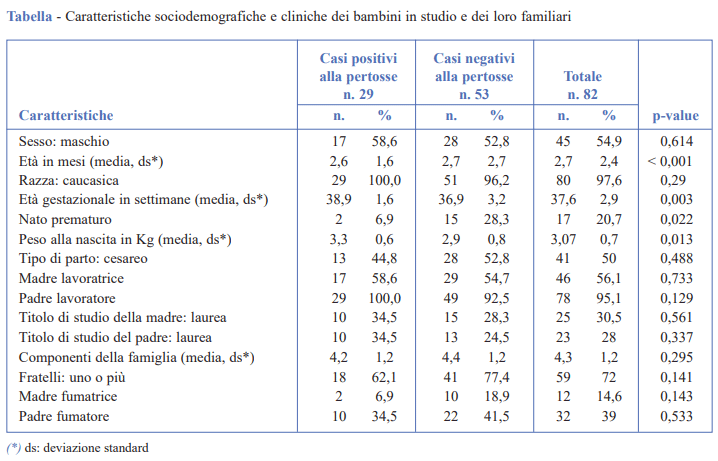
Da gennaio a dicembre 2018 sono stati arruolati nello studio 82 bambini con sintomi respiratori, dei quali 29 (35,4%) sono risultati positivi alla Bordetella pertussis e 53 (64,6%) negativi. Tra i casi positivi, 18 (62,1%) presentavano una co-infezione con almeno un altro virus: il 73,1% con rhinovirus, il 10,4% con virus parainfluenzali, il 6,0% con metapneumovirus, il 4,5% con enterovirus, il 3,0% con bocavirus e l’1,5% con adenovirus. Il 93,0% dei casi confermati in laboratorio rispondeva alla definizione di caso dell’ECDC, il restante 7,0% aveva invece sintomi atipici. Tra i pazienti che avevano una co-infezione con altri virus la percentuale che rispondeva alla definizione di caso clinico dell’ECDC era dell'88,9%. Le caratteristiche sociodemografiche e cliniche dei bambini arruolati nello studio e dei loro familiari sono riportate nella Tabella. L’età media all’esordio dei sintomi era di 2,6 mesi per i bambini positivi alla pertosse e di 2,7 mesi per quelli negativi (p-value < 0,001); il 54,9% del campione era di sesso maschile. L’età gestazionale media era di 38,9 settimane per i pazienti con pertosse e 36,9 per i pazienti con altre infezioni respiratorie (p-value = 0,003). La percentuale di nati prematuri era del 20,7% nel totale del campione, del 6,9% nei bambini con pertosse e del 28,3% in quelli con altre infezioni respiratorie (p-value = 0,022). Il peso medio alla nascita nei bambini con pertosse era più alto rispetto ai pazienti con altre infezioni respiratorie (3,3 kg vs 2,9 kg; p-value = 0,013). Il numero medio dei componenti del nucleo familiare era molto simile tra i due gruppi di bambini.
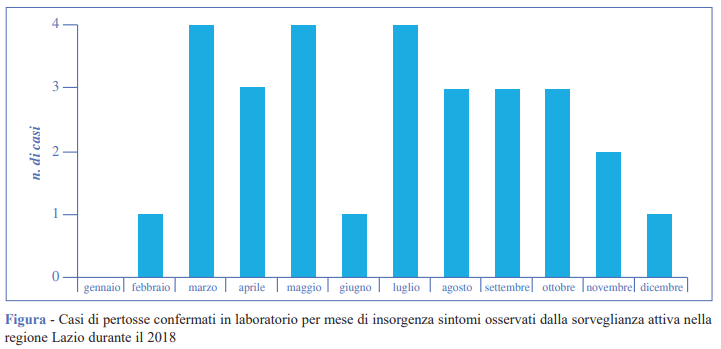
Il maggior numero di casi si è presentato ai DEA in primavera (31%) e in estate (41,4%) (Figura). Nei due ospedali che hanno attivato la sorveglianza attiva come rappresentativa dell’intera casistica della regione Lazio nel corso del 2018, la stima dell'incidenza della pertosse è stata pari a 66,8 casi per 100.000 bambini sotto l’anno di vita. Il tempo intercorso tra l’inizio dei sintomi e l’esecuzione dell’aspirato è stato: entro i 7 giorni dall’inizio dei sintomi per il 42% dei casi di pertosse, entro i 14 giorni per il 31% dei casi ed entro i 28 giorni per il 17% dei casi. Il 10% dei casi ha effettuato l’aspirato oltre il 28° giorno dall’insorgenza dei sintomi.
La durata media del ricovero è stata di 10,5 giorni e il 17,2% dei pazienti positivi alla pertosse ha sviluppato complicanze durante il ricovero. Le più frequenti sono state: il ricovero in terapia intensiva (10,3%), ipossia (6,9%) e sepsi (3,4%). Per quanto riguarda lo stato vaccinale, degli 82 pazienti arruolati, 41 avevano un’età inferiore a due mesi, per cui non erano eleggibili alla vaccinazione. Tra i pazienti eleggibili, 13 (31,7%) hanno ricevuto la prima dose di vaccino nelle due settimane precedenti ai sintomi; di questi, 8 erano casi di pertosse, mentre 5 avevano un’altra infezione respiratoria. Solo 4 pazienti hanno ricevuto la dose di vaccino e nessuno di questi è risultato positivo al test diagnostico per la pertosse.
La stima dell’efficacia vaccinale grezza, calcolata come almeno una dose di vaccino, è stata del 30,0% (IC 95%: -198,07-83,56). Aggiustando l’efficacia vaccinale, per età gestazionale e tempo intercorso tra inizio sintomi e aspirato nasofaringeo, è risultata pari al 36,5% (IC 95%: -278,8 -89,00).
Conclusioni
La pertosse è ancora un problema di salute pubblica nella maggior parte dei Paesi europei, nonostante l'elevata copertura vaccinale (5).
I dati sull'incidenza variano principalmente a causa delle differenze nei sistemi di sorveglianza, nelle definizioni di caso utilizzate e nei metodi di diagnosi. Tutti fattori che, di conseguenza, influiscono sulla notifica della malattia provocando una importante sottostima del fenomeno. Secondo i dati riportati all’ECDC, l'Italia è un Paese a bassa incidenza, con un tasso nei bambini di età inferiore ai 12 mesi, che varia da 0,8 per 100.000 abitanti nel 2012 a 1,7 per 100.000 nel 2016. La fascia di età più colpita è quella dei bambini di età inferiore ai 12 mesi, con un tasso di notifica di 51,6 casi per 100.000 abitanti nel 2016. I dati del 2017 non sono ancora disponibili (4).
Poiché la protezione indotta dai vaccini è limitata nel tempo ed è estremamente difficile raggiungere valori elevati di copertura vaccinale negli adulti, la pertosse continua a circolare e si verificano focolai epidemici. I bambini sotto l'anno di vita pagano il prezzo più alto in termini di morbilità e mortalità, perché non completano il percorso vaccinale prima dei 12 mesi.
Anche nella regione Lazio la percentuale di sottostima sembra essere elevata se si considera che l’incidenza stimata solo dai due ospedali inclusi in questa sorveglianza è più alta rispetto all’incidenza stimata nell'intera regione Lazio dal Ministero di Salute, sulla base delle notifiche regionali (10). Nella regione Lazio, infatti, l'epidemiologia della pertosse ha mostrato cambiamenti significativi; dal 2005 al 2017, in particolare nella fascia di età 0-3 anni, si è registrato un aumento del numero di casi e nel 2012 si è evidenziato il picco, raggiungendo un tasso di incidenza del 31,7 per 100.000 residenti nel 2016, il più alto dell'intero periodo di osservazione; l'ultima incidenza segnalata, nel 2017, è pari a 29,0 per 100.000 abitanti. In questo contesto, il rafforzamento della sorveglianza e della conferma di laboratorio sarà fondamentale per definire meglio l’impatto reale della malattia in futuro.
L'immunizzazione durante la gravidanza ha dimostrato di essere sicura e resta la strategia più efficace nella prevenzione delle infezioni e dei ricoveri nei bambini sotto l'anno di età (11, 12), soprattutto alla luce dei risultati relativi all’efficacia sul campo della vaccinazione nel primo anno di vita, ottenuti anche grazie al nostro studio, che è risultata pari al 36,5%.
Il Piano nazionale per la prevenzione vaccinale 2017-2019 ha inserito una raccomandazione specifica per l'immunizzazione delle donne in gravidanza contro la pertosse a partire dalla 28a settimana di gestazione (13).
Migliorare i sistemi di sorveglianza della pertosse è fondamentale per misurare l’incidenza reale della malattia, migliorare la diagnosi e pianificare correttamente le strategie di immunizzazione.
Dichiarazione sui conflitti di interesse
Gli autori dichiarano che non esiste alcun potenziale conflitto di interesse o alcuna relazione di natura finanziaria o personale con persone o con organizzazioni che possano influenzare in modo inappropriato lo svolgimento e i risultati di questo lavoro.
Riferimenti bibliografici
- European Centre for Disease Prevention and Control. Annual Epidemiological Report 2016 - Pertussis. Stockholm: ECDC; 2016.
- Lapidot R, Gill CJ. The pertussis resurgence: putting together the pieces of the puzzle. Trop Dis Travel Med Vaccines 2016;2:26.
- Burdin N, Handy LK, Plotkin SA. What is wrong with pertussis vaccine immunity? The problem of waning effectiveness of pertussis vaccines. Cold Spring Harb Perspect Biol 2017;9(12).
- European Centre for Disease Prevention and Control. EUVAC-NET.
- Heininger U, André P, Chlibek R, et al. Comparative epidemiologic characteristics of pertussis in 10 Central and Eastern European Countries, 2000-2013. PLoS One 2016;11(6):e0155949.
- Qin X, Galanakis E, Martin ET, et al. Multitarget PCR for diagnosis of pertussis and its clinical implications. J Clin Microbiol 2007;45:506-11.
- Güriş D, Strebel PM, Bardenheier B, et al. Changing epidemiology of pertussis in the United States: increasing reported incidence among adolescents and adults, 1990-1996. Clin Infect Dis 1999;28(6):1230-7.
- Wood N, McIntyre P. Pertussis: review of epidemiology, diagnosis, management and prevention. Paediatr Respir Rev 2008;9(3):201-11.
- European Centre for Disease Prevention and Control. EU case definitions (Pertussis).
- Servizio Regionale per l'Epidemiologia, Sorveglianza e controllo delle Malattie Infettive. Malattie prevenibili da vaccino - Regione Lazio 2005-2017 .
- GGkentzi D, Katsakiori P, Marangos M, et al. Maternal vaccination against pertussis: a systematic review of the recent literature. Arch Dis Child Fetal Neonatal Ed 2017;102(5):F456-F63.
- Baxter R, Bartlett J, Fireman B, et al. Effectiveness of vaccination during pregnancy to prevent infant Pertussis. Pediatrics 2017;139(5):e20164091.
- Hoshi SL, Seposo X, Okubo I, et al. Cost-effectiveness analysis of pertussis vaccination during pregnancy in Japan. Vaccine 2018;36(34):5133-40.

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale