I disturbi motori nella demenza: uno strumento per la diagnosi e l’intervento precoci
Valentina Moroa,b , Elena Faccia, Stefania Amatoa, Georgeta Stefanescua, Valeria Gobbettoa, Giorgia Fontanac, Vincenzo di Francescoc, Giuseppe Gambinaa
aCentro Medico Specialistico-Memory Center (CEMS), Verona
bLaboratorio di Neuropsicologia (NPSY-LAB-VR), Dipartimento di Scienze Umane, Università degli Studi di Verona
cGeriatria A, Azienda Ospedaliera Universitaria Integrata, Verona
Citare come segue: Moro V, Facci E, Amato S, Stefanescu G, Gobbetto V, Fontana G, di Francesco V, Gambina G. I disturbi motori nella demenza: uno strumento per la diagnosi e l'intervento precoci. Boll Epidemiol Naz 2020; 1(2):22-31. DOI: https://doi.org/10.53225/BEN_004
Motor disorders in dementia: a tool for early diagnosis and intervention
Introduction
Although dementia is essentially characterized by a progressive decline of cognitive functions, some data suggest that since the earlier stages this involves motor aspects as well. The aim of this study is the analysis of the presence and severity of motor disorders in the diff erent stages of the disease.
Materials and methods
The “Exam Geronto-Psychomoteur” (EGP) was administered to patients suff ering from Alzheimer dementia, with age between 60 and 100 years, education ≥ 5 years, absence of behavioral disorders. Results were compared with those of age-matched healthy controls.
Results
67 patients were grouped into four severity classes (Mini-Mental State Examination score 24,51-30: n. 14; MMSE = 19,51-24,5: n. 19; MMSE = 15-19,5: n. 20; MMSE = < 15: n.14) and compared to two groups of healthy, age-matched subjects (age 81-85: n. 32, for MMSE = 19,51-24,5, 15-19,5 and < 15 and 76-80: n. 46 for MMSE = 24,51-30). Disorders in the motor system were found since the very early stages of the disease, in particular in dynamic coordination and muscular hypertonia. The most precocious cognitive defi cits involve praxis, memory, orientation, perceptual functions and communication. Finally, in the later stages of illness, cognitive and motor areas become gradually worse.
Conclusions
The Exam Geronto-Psychomoteur is useful to identify both motor and cognitive defi cits since the early stages of Dementia and may be considered as a good screening instrument, preliminary to an in-depth and specifi c assessment. It may also be useful for devising specifi c interventions aimed at maintaining autonomy in elderly people.
Key words: dementia; motor deficits; progression of symptoms
Introduzione
Nel panorama delle patologie degenerative esistono forme caratterizzate da un esordio legato prevalentemente ad aspetti motori, come la malattia di Parkinson, mentre le altre forme di demenza, in particolare la malattia di Alzheimer, vengono considerate essenzialmente disturbi delle funzioni cognitive. Tuttavia, alcuni studi suggeriscono come anche nella demenza e nelle forme precliniche di deterioramento cognitivo, ci possa essere un precoce interessamento degli aspetti motori. Per esempio, nel Mild Cognitive Impairment (MCI) sono state individuate alterazioni nella motricità fine (1), nella destrezza manuale (2) e nella velocità del cammino (3). Potenziali parametri predittivi di declino cognitivo sembrano essere le alterazioni della marcia, in particolare la riduzione della velocità e la variabilità del passo (4, 5). Le alterazioni motorie progrediscono con la comparsa di alterazioni posturali e difficoltà nel controllo del passo (6). Meno frequenti nelle fasi iniziali, ma comunque descritti, sono i cambiamenti nella mimica facciale, e la comparsa di rigidità, bradicinesia e tremore. Infine, nelle fasi avanzate, vengono riportati disturbi della marcia, dell’equilibrio, aumento del tono muscolare e mioclonie (7). Alcuni autori riportano anche che, fin dalle fasi precoci della malattia di Alzheimer, il comportamento apatico e la sedentarietà favoriscono l’immobilizzazione e accelerano il declino fisico (6).
Tali dati suggeriscono l’importanza di strumenti di misura capaci di rilevare sia aspetti cognitivi che motori. Tuttavia, ad oggi, gli strumenti a disposizione del clinico e del neuropsicologo sono limitati e, in generale, non prevedono un’osservazione integrata degli aspetti cognitivi e sensori-motori. Scopo dello studio è l’analisi della presenza e della severità dei disturbi psico-motori nella demenza.
I dati qui presentati sono i risultati preliminari di un più ampio progetto di validazione dell’Exam Geronto-Psichomoteur (EGP). Tale progetto ha previsto la traduzione (con back-translation) in lingua italiana dell’originale batteria francese (8) e prevede la somministrazione ad una popolazione di circa 500 soggetti anziani neurologicamente sani, di età compresa tra i 60 e i 100 anni (9), e di circa 120 pazienti con demenza (Comitato Etico Provinciale di Verona e Rovigo, Prot. CESC926).
Materiali e metodi
Reclutamento partecipanti
Il reclutamento dei soggetti è avvenuto presso il reparto di Geriatria A dell’Azienda Ospedaliera Universitaria Integrata, il Centro Medico Specialistico (CEMS) Memory Center - e l’Associazione Familiari Malati di Alzheimer Onlus di Verona nell’arco di tempo compreso tra giugno 2016 e settembre 2018. I criteri di inclusione prevedevano: diagnosi di malattia di Alzheimer (secondo i criteri McKhann e colleghi) (10), età compresa tra i 60 e i 100 anni, scolarità ≥ 5 anni, assenza di disturbi comportamentali (in particolare depressione e disinibizione) e comprensione verbale sufficientemente conservata. Per i soggetti di controllo i criteri di inclusione prevedevano: età ≥ 60 e ≤ 100 anni, assenza di patologie neurologiche o psichiatriche (in particolare depressione), assenza di disabilità sensoriale importante, deficit di linguaggio e assenza di esiti di fratture recenti.
Secondo le indicazioni fornite da Starkstein e colleghi (11), i pazienti con diagnosi di demenza sono stati divisi in 4 gruppi in base al livello di gravità misurato attraverso il Mini Mental State Examination (MMSE), che fornisce un indice generale di abilità cognitive. I gruppi risultavano così distribuiti: Molto lieve, MMSE = 24,51-30; Lieve, MMSE = 19,51-24,5; Moderato, MMSE = 15-19,5; Severo, MMSE < 15. Il confronto tra pazienti e controlli è stato effettuato sulla base dell’età anagrafica. Di conseguenza il gruppo dei Molto lievi è stato confrontato con un gruppo di controllo di età 76-80, mentre gli altri gruppi sono stati confrontati con un gruppo di età 81-85. Sono stati esclusi pazienti con disturbi del comportamento e difficoltà di comprensione verbale tali da inficiare i risultati della prova.
Esame geronto-psicomotorio
La batteria comprende prove cognitive e motorie che vengono presentate con un ordine preciso tale da evitare effetti di interferenza. Inoltre, l’organizzazione delle prove garantisce la possibilità di effettuare il richiamo differito nei compiti di memoria. Le funzioni cognitive indagate sono: attenzione (attenzione selettiva, esecuzione di ordini semplici e identificazione di forme e colori), memoria percettiva (ricordo di colori e posizioni di parti corporee, richiamo facilitato e riconoscimento), memoria verbale (rievocazione immediata, differita e differita facilitata di parole), linguaggio e comunicazione (linguaggio spontaneo, comprensione, espressione mimica, gestualità), percezione (riconoscimento di una melodia, riproduzione di una struttura ritmica, stereognosia, identificazione e riconoscimento di immagini, lettura di un breve testo), rappresentazione corporea (identificazione di differenze tra due figure umane, riconoscimento di parti corporee mancanti, identificazione di parti corporee, denominazione di parti corporee, imitazione di posizioni), prassie (uso delle posate, pantomime, scrittura, copia di figure geometriche, costruzione della piramide con i cubi), orientamento temporale (data del giorno, data di nascita, lettura dell’orologio, orientamento nel calendario, organizzazione temporale di eventi), orientamento spaziale (orientamento geografico, organizzazione topologica, divisione di linee, orientamento di oggetti, spostamenti nello spazio). Le capacità motorie indagate sono: coordinazione statica (mantenersi in piedi senza appoggio e in punta di piedi), coordinazione dinamica (camminare per 10 m, camminare a passo accelerato), tono muscolare (misurato attraverso prove di mobilizzazione delle articolazioni degli arti superiori ed inferiori), motricità fine degli arti superiori (abbottonare, pianotage, opposizione pollice alle altre dita, raccogliere una moneta) e motricità degli arti inferiori (posizionamento dei piedi su delle orme, calcio a un pallone, sequenza di posizioni). La sequenza delle prove e i rispettivi punteggi sono presentati in Tabella 1. Non esistono nelle versioni precedenti dei punteggi di cut-off (8).
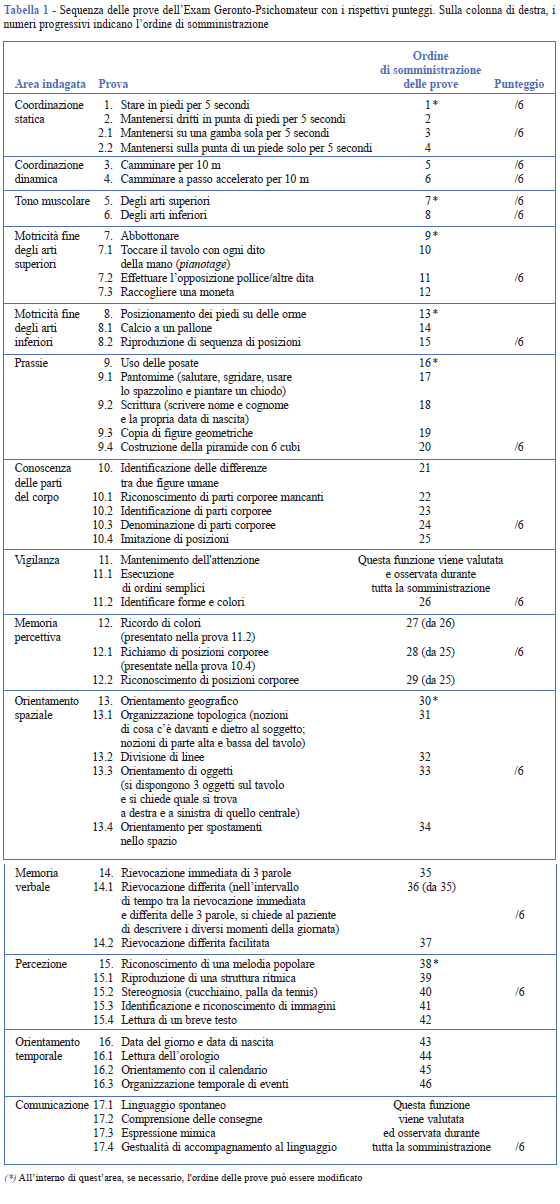
Somministrazione
Preliminarmente sono state raccolte le informazioni sociodemografiche, tra cui: età, genere, situazione familiare (stato civile, numero di figli), professione svolta, scolarità e tipologia di attività fisica (esercizio motorio e frequenza settimanale). Quindi è stato somministrato l'MMSE, con l’obiettivo di collocare i pazienti nel gruppo di appartenenza in base alla gravità e con l’esclusione dei soggetti di controllo con un MMSE < 24. Insieme all'MMSE è stata somministrata la Geriatric Depression Scale (GDS) (12) per escludere situazioni di depressione maggiore. In questa fase preliminare sono stati anche raccolti altri dati, quali: le autonomie nelle attività di vita quotidiana e nelle attività strumentali (ADL e IADL) (13, 14), gli aspetti nutrizionali (attraverso il Mini Nutrition Assessment, MNA) (15). Tuttavia,
tutti questi dati non sono stati ad oggi analizzati e verranno considerati solo nella validazione finale, quando ci sarà una maggiore numerosità dei gruppi.
La somministrazione della batteria veniva effettuata in un luogo tranquillo e nei momenti della giornata scelti dal partecipante. Il partecipante sedeva davanti a un tavolino ed eseguiva tutte le prove da seduto, ad eccezione delle prove di coordinazione statica, coordinazione dinamica e di motricità fine degli arti inferiori. L’ordine delle prove è riportato nella Tabella 1.
La durata di somministrazione è stata mediamente di 1 ora, con un range che andava dai 45 minuti fino a un’ora e trenta. La prova prevede la possibilità di brevi pause e una somministrazione in due momenti diversi, se necessario (le uniche prove che hanno una tempistica obbligata sono quelle di memoria).
Analisi statistiche
Lo Shapiro Wilk Test ha confermato l’ipotesi di normalità di distribuzione del campione. I punteggi totali medi dei diversi gruppi di gravità sono stati comparati attraverso l’ANOVA ad una via. Per ogni gruppo di gravità il punteggio globale, il punteggio nelle sottoscale cognitive e motorie e i punteggi nelle diverse aree indagate sono stati confrontati con i rispettivi gruppi di controllo attraverso t-test a campioni indipendenti. Sono stati considerati come valori statisticamente significativi quelli con p ≤ 0,001 e p ≤ 0,01.
Risultati
Sono stati reclutati 67 pazienti (età media = 80,36 anni, range = 60-100; scolarità media = 7,46, range = 5-17) con diagnosi di malattia di Alzheimer, poi raggruppati per le 4 diverse classi di gravità (Molto lieve, MMSE = 24,51-30, n. 14; Lieve, MMSE = 19,51-24,5, n. 19; Moderato, MMSE = 15-19,5, n. 20; Severo, MMSE < 15, n. 14) (11). In base alla loro età media, tutti i gruppi, eccetto i Molto lievi, sono stati confrontati con i il gruppo di controllo di età 81-85 (n. 32), mentre il gruppo dei Molto lievi è stato confrontato un gruppo di età 76-80, n. 46).
Gruppo Molto lievi
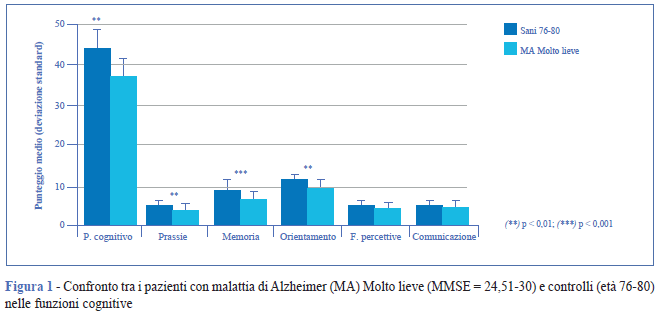
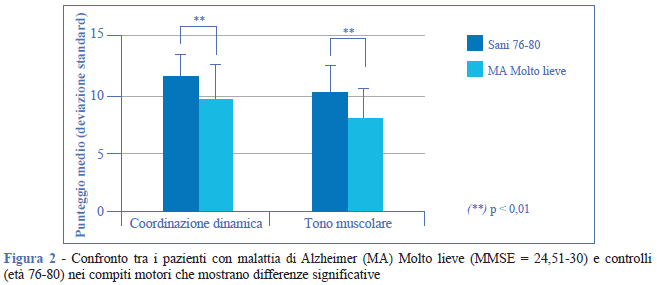
Il confronto tra pazienti con malattia di Alzheimer con punteggio MMSE = 24,51-30 e soggetti sani ha confermato la presenza di differenze significative in alcune funzioni cognitive quali: orientamento temporale e spaziale, prassie (p < 0,01) e memoria (p < 0,001) (Figura 1). Sono stati registrati anche deficit nelle funzioni motorie, in particolare nelle prove di coordinazione dinamica e tono muscolare (p < 0,01) (Figura 2).
Gruppo Lievi
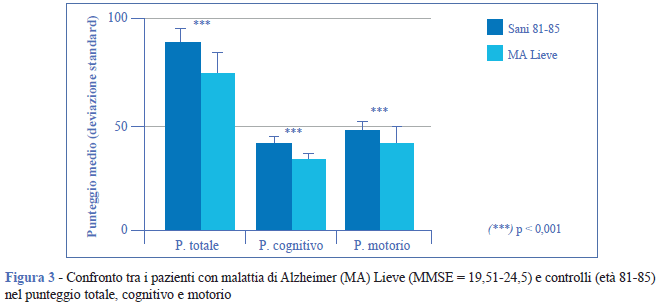
Il confronto di questo gruppo (MMSE = 19,51- 24,5), con i soggetti sani di 81-85 anni mostra differenze significative nel punteggio totale all’EGP e nei punteggi motorio e cognitivo (Figura 3). Inoltre, nel declino delle funzioni cognitive, oltre alle funzioni già trovate deficitarie, si registra il deficit delle capacità comunicative (Figura 4).
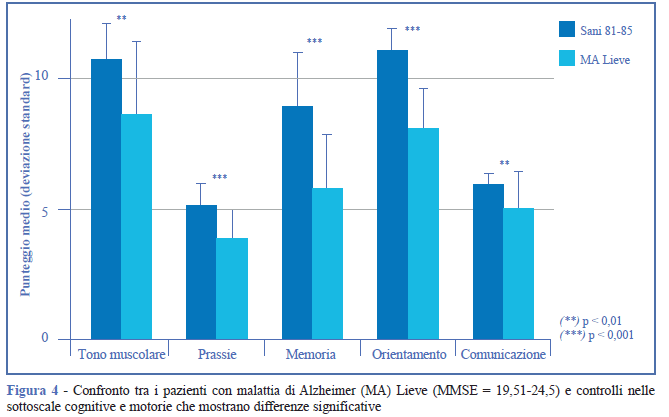
Gruppo Moderati
Nel confronto tra soggetti sani e con malattia di Alzheimer con livello di gravità moderato (MMSE = 15- 19,5), le funzioni cognitive che peggiorano risultano essere le funzioni percettive e la rappresentazione corporea. Dal punto di vista motorio, si registrano disturbi della motricità fine (Figura 5).
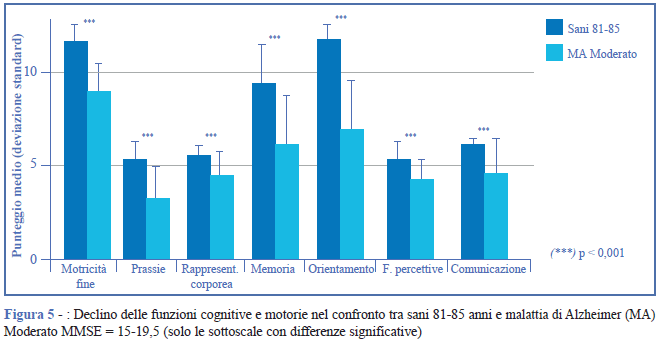
Gruppo Severo
Dal confronto dei soggetti sani e con malattia di Alzheimer con livello di gravità severa (MMSE < 15), tutti i domini sono risultati essere compromessi.
Confronto tra fasce di gravità
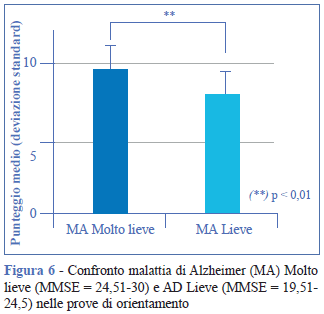
I risultati mostrano il declino dell’orientamento temporale (data del giorno, data di nascita, lettura dell’orologio, orientamento nel calendario, organizzazione temporale di eventi), e spaziale (orientamento geografico, organizzazione topologica, divisione di linee, orientamento di oggetti, orientamento di movimenti) nel passaggio da MMSE = 24,51-30 a 19,51-24,5 (p < 0,01) (Figura 6).
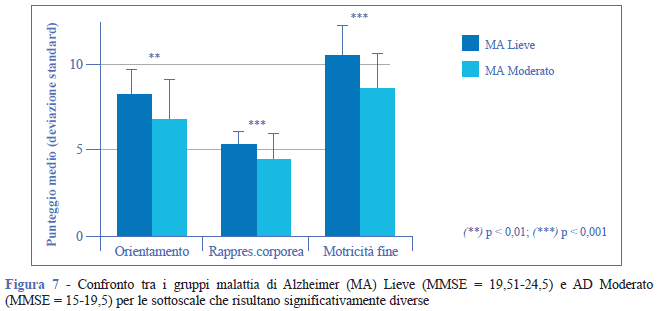
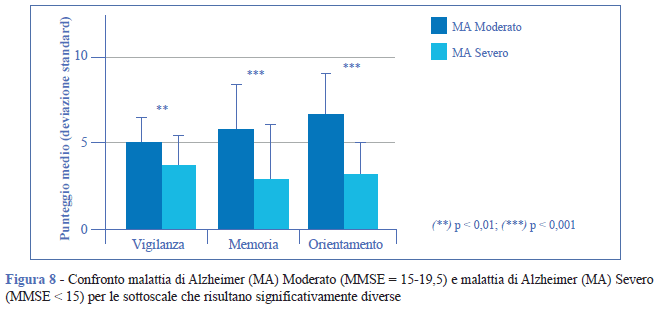
Nel confronto tra i gruppi 19,51-24,5 e 15-19,5 il declino si registra nel punteggio totale, nel punteggio cognitivo generale (in particolare nell’orientamento, p < 0, 01 e nella rappresentazione corporea, p < 0, 001) ma anche nella motricità fine (p < 0,001) (Figura 7). Infine, nel passaggio 15-19,5 e < 15 diventa significativo anche il peggioramento in memoria (p = 0,001), orientamento (p < 0, 001) e vigilanza (p = 0, 01) (Figura 8).
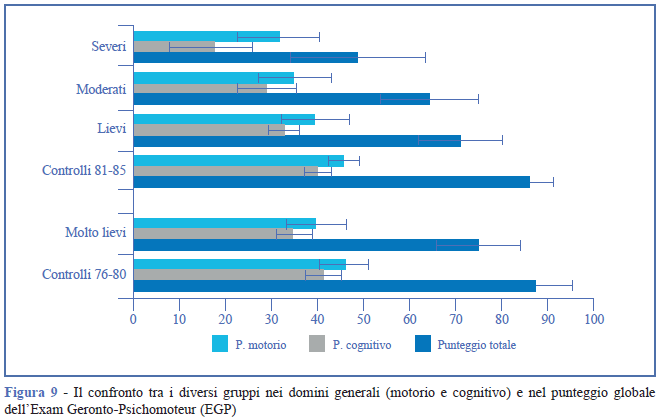
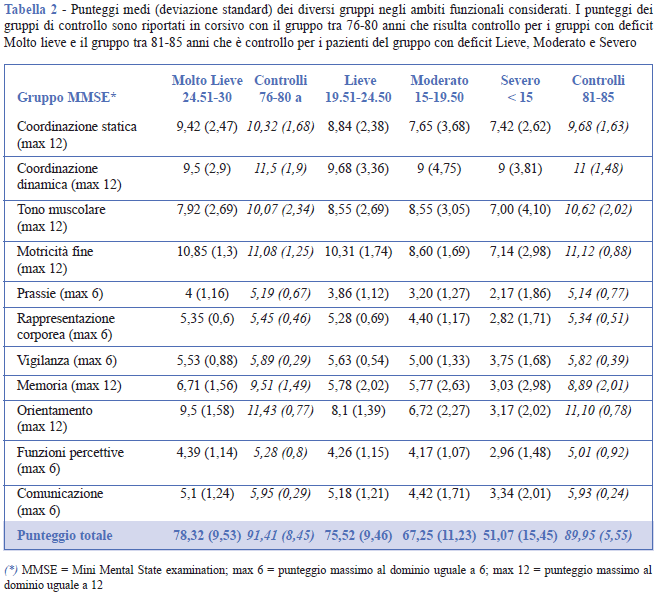
La Figura 9 mostra il confronto tra i gruppi nei due domini e nel punteggio generale, mentre la Tabella 2 mostra i risultati per ogni subtest.
Conclusioni
I risultati preliminari di questo studio mostrano che l’EGP è uno strumento di screening sensibile nell’individuazione precoce dei deficit motori e cognitivi del paziente con demenza e nella discriminazione dei disturbi rispetto al fisiologico processo di invecchiamento. La novità principale dello strumento è che offre un approccio integrato in grado di osservare contemporaneamente le abilità motorie e cognitive. Nello specifico, come suggerito da studi precedenti, le alterazioni motorie legate alla coordinazione dinamica e al tono muscolare sembrano essere indicatori utili per orientare verso una diagnosi precoce (4, 5). Un secondo punto di forza dello strumento risulta il fatto che l’EGP è sensibile a misurare i diversi gradi di gravità della demenza. Per questo si presta ad essere utilizzato nella definizione di piani di intervento psicomotorio. Di non secondaria importanza, si tratta di una batteria che è normalmente gradita ai pazienti ed effettuabile in un clima di serenità, senza lo stress della normale valutazione testistica. L’alternanza tra compiti cognitivi e motori e la varietà delle prove somministrate riflettono la dinamicità del test e ne aumentano il valore ecologico.
I risultati emersi confermano il progressivo declino delle funzioni cognitive associato all’aggravarsi della malattia e mostrano come già nelle fasi inziali di deterioramento siano presenti deficit motori. Nello specifico, mentre le prime funzioni cognitive compromesse sono l’orientamento, la memoria e le prassie, le funzioni motorie maggiormente coinvolte sono il tono muscolare e la coordinazione dinamica. Questo suggerisce la necessità di un’osservazione specifica ed accurata di questi aspetti, che apra alla possibilità di interventi mirati che sostengano il benessere e l’autonomia nel tempo.
Lo studio presenta alcuni limiti. Innanzitutto, la casistica ancora limitata porta a considerare questi dati come preliminari, quindi da confermare con maggiori numerosità e con gruppi di numerosità uguale. Nei risultati qui presentati infatti mancano le analisi di correlazione con gli altri test somministrati indaganti il tono dell’umore, le autonomie strumentali e di base della vita quotidiana e l’indice di nutrizione che richiedono maggiori numerosità. Inoltre, lo strumento ha dei tempi di somministrazione relativamente lunghi per cui può essere utile suddividere la valutazione in due momenti differenti ma vicini tra loro.
In conclusione, EGP si presenta come un buono strumento di utilizzo in ambito clinico e riabilitativo per la valutazione degli interventi psico-motori e cognitivi con il paziente con demenza.
Conflitti di interesse dichiarati: nessuno
Finanziamenti: nessuno
Comitato etico: Comitato Etico Provinciale di Verona e Rovigo (Protocollo CESC926) per entrambi i gruppi, soggetti neurologicamente sani e con demenza. Titolo dello studio: “La validazione italiana dell’esame Geronto-psicomotorio e la sua utilità in pazienti con demenza tipo Alzheimer”.
Authorship: tutti gli autori hanno contribuito in modo signifi cativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- Roalf DR, Rupert P, Mechanic-Hamilton D, Brennan L, Duda JE, Weintraub D, et al. Quantitative assessment of finger tapping characteristics in mild cognitive impairment, Alzheimer’s disease, and Parkinson’s disease. J Neurology 2018 Jun;265(6):1365-75. doi: 10.1007/s00415-018-8841-8
- de Paula JJ, Albuquerque MR, Lage GM, Bicalho MA, Romano-Silva MA, Malloy-Diniz LF. Impairment of fine motor dexterity in mild cognitive impairment and Alzheimer’s disease dementia: association with activities of daily living. Braz J Psychiatry 2016 Jul-Sep ;38(3):235-8. doi: 10.1590/1516- 4446-2015-1874
- Hunter SW, Divine A, Frengopoulos C, Montero Odasso M. A framework for secondary cognitive and motor tasks in dual-task gait testing in people with mild cognitive impairment. BMC Geriatr 2018 Sep;18(1):202. doi: 10.1186/s12877-018-0894-0
- Wirths O, Bayer TA. Motor impairment in Alzheimer’s disease and transgenic Alzheimer’s disease mouse model. Genes, Brain and Behavior 2008 Feb;7 (Suppl 1):1-5. doi: 10.1111/j.1601-183X.2007.00373.x
- Gillain S, Dramè M, Lekeu F, Wojtasik V, Ricour C, Croiser JL. Gait speed or gait variability. Wich one to use as a marker of risk to develop Alzheimer disease? A pilot study. Aging Clin Exp Res 2008;28(2): 249-55. doi.org/10.1007/s40520-015-0392-6
- Orta-Salazar E, Feria-Velasco AI, Diaz-Cintra S. Alteraciones en la corteza motora primaria en la enfermedad de Alzheimer: estudio en el modelo 3xTg-AD. Neurologia 2019 Sep; 34(7):429-436. doi: 10.1016/j.nrl.2017.02.016
- Gambina G, Pasetti C. Introduzione alla malattia di Alzheimer e alle altre demenze. Dalla clinica alla bioetica. Verona: Edizioni Libreria Cortina Verona; 2008.
- Michel S, Soppelsa R, Albaret JM. Examen Géronto Psychomoteur EGP. Paris: Hogrefe; 2010.
- Amato S, Facci E, Bertagnoli S, Gobbetto V, Fontana V, Di Francesco V, Gambina G, Moro V. L’Esame Geronto-Psicomotorio: la validazione di uno strumento di osservazione del processo di invecchiamento cognitivo e motori. In: Convegno “Il contributo dei centri per i disturbi cognitivi e le demenze nella gestione integrata dei pazienti”. Roma, Istituto Superiore di Sanità, 15-16 novembre 2018.
- McKahnn G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of NINCDSADRDA Work Group under the auspices of Department of Health and Human Service Task Force on Alzheimer’s Disease. Neurology 1984 Jul;34(7):939-44. doi: 10.1212/wnl.34.7.939
- Starkstein SE, Jorge R, Mizrahi R, Robinson RG. A diagnostic formulation for anosoagnosia in Alzheimer's disease. J Neurol Neurosurg Psychiatry. 2006 Jun;77(6):719-25. doi: 10.1136/ jnnp.2005.085373
- Sheikh JI, Yesavage A. Geriatric depression scale (GDS): recent evidence and development of a shorter version. In: Brink TL (Ed). Clinical gerontology: a guide to assessment and intervention. New York: Haworth; 1986:165-73.
- Katz S, Ford AB, Moskowitz RW, Jackson BA, Jaffe MW. Studies of illness in the aged. The index of ADL: a standardized measure of biological and psychological function. JAMA 1963; 185:914-9. doi: 10.1001/jama.1963.03060120024016
- Lawton MP, Brody EM. Assessment of older people: self -maintaining and instrumental activities of daily living. Gerontologist 1969; 9(3):179-86.
- Vellas B, Guigoz, Y, Garry V, Nourhashemi, F, Bennahum D, Lauque S, et al. The mini nutritional assessment (MNA) and its use in grading the nutritional state of elderly patients. Nutrition 1999 Feb; 15(2): 116-22. doi: 10.1016/s0899- 9007(98)00171-3

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale