Il Registro Italiano delle Protesi Impiantabili: una nuova realtà per la sicurezza del paziente
Marina Torrea , Eugenio Carrania, Michela Franzòa,b, Enrico Ciminelloa,c, Iuliia Urakcheevaa,d, Duilio Luca Bacoccoa,e, Riccardo Valentinia,e, Simona Pascuccia,b, Saif Madia,f, Carla Ferraraa, Virgilia Toccacelig, Letizia Sampaoloh, Stefania Ceccarellia, Alessia Biondia, Paola Laricchiutaa
a Segreteria Scientifica della Presidenza, Istituto Superiore di Sanità, Roma
b Dipartimento di Ingegneria Meccanica e Aerospaziale (DIMA), Sapienza Università di Roma
c Dipartimento di Scienze Statistiche, Sapienza Università di Roma
d Dipartimento di Comunicazione e Ricerca Sociale, Sapienza Università di Roma
e Dipartimento di Ingegneria Informatica, Automatica e Gestionale (DIAG) “Antonio Ruberti”, Sapienza Università di Roma
f Dipartimento di Informatica, Sapienza Università di Roma
g Centro di Riferimento per le Scienze Comportamentali e la Salute Mentale, Istituto Superiore di Sanità, Roma
h Centro Nazionale per la Prevenzione delle Malattie e la Promozione della Salute, Istituto Superiore di Sanità, Roma
Citare come segue: Torre M, Carrani E, Franzò M, Ciminello E, Urakcheeva I, Bacocco DL, Valentini R, Pascucci S, Madi S, Ferrara C, Toccaceli V, Sampaolo L, Ceccarelli S, Biondi A, Laricchiuta P. Il Registro Italiano delle Protesi Impiantabili: una nuova realtà per la sicurezza del paziente. Boll Epidemiol Naz 2021;2(2):16-23. DOI: https://doi.org/10.53225/BEN_015
The Italian Implantable Prostheses Registry: a new framework for patient safety
Introduction
The Italian Implantable Prostheses Registry (RIPI) was designed to monitor implants’ safety and performance, assessing outcomes of the surgical procedures and ensuring patients and implant traceability. This paper aims to present the RIPI project and its dimension in terms of procedures to be monitored.
Materials and methods
The RIPI’s architecture is modular and consists of a main body coordinating different registries for specific implantable devices. Data collection will use hospital discharges data integrated by an additional Minimum Data Set, specific for each class of implanted devices and defined by dedicated technical committees. The number of procedures expected to be monitored by RIPI was computed and the costs associated to the related hospital admissions were estimated.
Results
Currently, RIPI is designed to consider the implants of the following devices: joint prostheses, spinal devices, implantable cardioverter-defibrillators and pacemakers, and heart valves. In 2019, nearly 400.000 such procedures were performed in Italy. Their cost represented more than 3% of the national public healthcare expenditure. Data collection has already started for joint prostheses where the "Data quality first" approach is applied at all stages. The architecture of the future RIPI data collection platform might support collaboration with other international registries.
Conclusions
In the last two decades, the procedures considered by RIPI have doubled. In the future, survival analysis produced by RIPI can support the Ministry of Health in supervising medical devices and medical device manufacturers in monitoring the quality of their products, as required by EU Regulation 2017/745, thus improving the quality of patient care and reducing healthcare expenditure.
Key words: registries; prostheses and implants; public health
Introduzione
Un registro di protesi impiantabili è un sistema organizzato di raccolta dati volto a migliorare la qualità delle cure erogate al paziente. Tale sistema permette di identificare e descrivere gli impianti, valutarne sicurezza e prestazioni e individuare i pazienti da richiamare nel caso in cui il dispositivo che è stato loro impiantato presenti problemi. Affinché un registro possa fornire risultati utili a guidare la pratica clinica, è importante che la raccolta dati sia effettuata su scala ragionevolmente generalizzabile, quindi a livello di Regione, intero Paese o anche Paesi combinati e che copra senza esclusioni la popolazione di riferimento (1, 2). Ad esempio, nel 2010 nel Regno Unito, grazie alle rilevazioni del National Joint Registry, attivo dal 2003 e oggi il più grande e completo nel suo genere al mondo con oltre tre milioni di interventi registrati (www.njrcentre.org.uk.../), è stato possibile rilevare che i tassi di revisione delle protesi con accoppiamento metallo su metallo (MoM) erano più alti rispetto a quelli delle altre protesi. Sulla base di queste segnalazioni, l’agenzia regolatoria inglese ha emesso avvisi di sicurezza e, successivamente, di divieto di impianto di tali protesi (3-5) che hanno portato a un loro richiamo mondiale, sollecitando l'attenzione dei decisori sull’importante ruolo dei registri nella tutela della salute dei pazienti.
In Italia, le importanti conseguenze degli impianti MoM e di un particolare tipo di protesi mammaria hanno impresso un'accelerazione alla definizione del quadro normativo a supporto dell’attività di registrazione dei dispositivi impiantabili, parallelamente a quanto veniva stabilito a livello europeo. Nel 2012, dopo una serie di provvedimenti proposti sin dal 2002 e mai approvati, sono istituiti, tra gli altri, i registri degli impianti protesici, rimandando a un successivo Decreto del Presidente del Consiglio (DPCM) e al relativo Regolamento la definizione delle modalità di realizzazione (6). Il 2017 rappresenta una pietra miliare in questo percorso con la pubblicazione del Regolamento Europeo sui dispositivi medici (7), che riconosce ai registri un ruolo centrale per la valutazione indipendente della sicurezza e della prestazione e per la tracciabilità, e del DPCM che istituisce, tra gli altri, il Registro Nazionale delle Protesi Impiantabili, presso l’Istituto Superiore di Sanità (ISS), quale ente di riferimento nazionale (8). Successivamente, l’alimentazione dei registri da parte degli operatori sanitari e delle Regioni diventa obbligatoria (9) e la raccolta e il conferimento dei dati da parte delle Regioni rappresenta un adempimento ai fini della verifica dell’erogazione dei livelli essenziali di assistenza (10).
In questo contesto, alla fine del 2018, il Ministero della Salute ha richiesto al gruppo di lavoro del Registro Italiano Artroprotesi (RIAP) dell’ISS di avviare le attività affinché, entro il biennio 2019-2021, venissero poste le basi del futuro Registro Nazionale delle Protesi Impiantabili, estendendo ad altri dispositivi l’esperienza del RIAP, ormai consolidata in numerosi contesti regionali (11).
Obiettivo del presente lavoro è presentare, a due anni dall’avvio delle attività, lo stato di avanzamento dei lavori di costruzione del Registro Nazionale delle Protesi Impiantabili che, per facilitare la sua identificazione a livello internazionale, è stato ridenominato Registro Italiano delle Protesi Impiantabili (RIPI). In particolare, verranno evidenziati i criteri che ne hanno guidato la progettazione e presentati i risultati di un’esplorazione dell’archivio nazionale delle schede di dimissione ospedaliera (SDO), per le procedure che verranno monitorate dai registri inclusi nel primo nucleo del RIPI (impianto di protesi ortopediche, dispositivi spinali, pacemaker e defibrillatori, valvole cardiache), nonché la stima del loro impatto sulla spesa sanitaria.
Materiali e metodi
L'architettura ideata per il RIPI è modulare. Una struttura di coordinamento trasversale governa singoli registri, specifici per varie categorie di dispositivi impiantabili, ciascuno organizzato come federazione di registri regionali.
Il modello di flusso informativo del RIPI estende agli altri registri quello già consolidato dal RIAP per le protesi ortopediche (12). Per la raccolta dati utilizza le SDO integrate da un Minimum Data Set (MDS) aggiuntivo, specifico per ogni classe di dispositivi impiantati, e si basa su due flussi che convogliano all’ISS i dati relativi, rispettivamente, ai ricoveri e all'identificazione e caratterizzazione del dispositivo medico (DM) impiantato. Inoltre, analogamente al RIAP, prevede che la raccolta dei dati rispetti i principi della sicurezza informatica e della tutela dei dati personali e che sui dati ricevuti venga applicato un rigoroso controllo di qualità, prima della loro elaborazione e presentazione. Per ciascun registro viene costituito un tavolo tecnico multidisciplinare, al quale partecipano le società scientifiche di settore e il Gruppo di Lavoro RIPI dell’ISS. Sulla base delle indicazioni degli esperti e di un’attenta analisi della letteratura, ciascun tavolo tecnico definisce: i) le procedure di interesse e i codici ICD9-CM (International Classification of Diseases 9th Ninth Revision, Clinical Modification) che le descrivono; ii) l’MDS che estende la SDO con le informazioni specifiche relative agli interventi e all’identificazione dei dispositivi impiantati; iii) la tassonomia dei dispositivi, identificandone le proprietà tecniche. Essa rappresenta la base per costruire il Dizionario dei DM, costantemente alimentato dalle aziende produttrici con le informazioni necessarie per identificare e caratterizzare il dispositivo impiantato.
Per figurare la dimensione del volume di interventi che i registri inclusi nel primo nucleo del RIPI dovranno monitorare a livello nazionale, una volta entrati a regime, sono state estratte dal database SDO nazionale del Ministero della Salute tutte le dimissioni che, per gli anni 2001-2019, includevano almeno uno dei codici di procedura considerati di interesse. Per il solo anno 2019, sono stati conteggiati i diversi codici DRG (Disease Related Groups) (13) associati alle dimissioni per stimarne l’impatto sulla spesa sanitaria.
Lo studio della strategia comunicativa del RIPI è condotto con il Dipartimento di Comunicazione e Ricerca Sociale della Sapienza Università di Roma. Applicando i metodi della ricerca sociale e della teoria della comunicazione, si stanno esaminando i bisogni conoscitivi dei diversi stakeholder del RIPI (rappresentanti dei pazienti, società scientifiche, autorità sanitarie nazionali e regionali, enti regolatori, aziende produttrici) al fine di rendere disponibili prodotti che soddisfino le specifiche esigenze, tra i quali il sito web del progetto e strumenti per valutare l’efficacia e l’efficienza del messaggio comunicativo.
Risultati
Architettura del RIPI
Il criterio guida per la scelta dei dispositivi attualmente inclusi nel RIPI è stato quello dell’appartenenza alla classe di rischio più elevata (Classe III) e alle categorie a maggiore impatto di spesa. Oltre alle protesi ortopediche, sono stati considerati i dispositivi impiantabili per chirurgia spinale, i defibrillatori, i pacemaker e le valvole cardiache (Figura 1). Sono dispositivi che ricadono in due categorie della Classificazione Nazionale dei Dispositivi medici (P e J) che, nel 2019, hanno inciso per oltre il 25% sulla spesa nazionale dei dispositivi medici per oltre un miliardo di Euro (14).

Organizzazione dei tavoli tecnici
Dal 2008, le attività del RIAP sono supervisionate da un Comitato scientifico in cui sono rappresentati tutti gli attori che hanno contribuito a definire il modello di flusso informativo e il set di variabili da raccogliere.
A oggi, sono stati istituiti i tavoli tecnici per il Registro Italiano Defibrillatori E Pacemaker (RIDEP) e per il Registro Italiano Dispositivi Impiantabili per chirurgia Spinale (RIDIS) che stanno perfezionando l’MDS e la tassonomia dei dispositivi. Nel primo, sono stati coinvolti gli esperti di settore dell’ISS e i referenti nominati dall’Associazione Italiana Aritmologia e Cardiostimolazione (15), già esperta nell’organizzazione del proprio registro pacemaker e defibrillatori, per definire in modo condiviso l’MDS richiesto dal RIPI (ripi.iss.it/...). Per il RIDIS, sono stati coinvolti chirurghi vertebrali e neurochirurghi, esperti nominati, rispettivamente, dalla Società Italiana di Ortopedia e Traumatologia e dalla Società Italiana di Neurochirurgia (https://ripi.iss.it/...). La collaborazione tra esperti clinici nel settore, ingegneri e fabbricanti è stata fondamentale per costruire una tassonomia funzionale al raggiungimento degli obiettivi di ciascun registro.
La definizione delle variabili dell’MDS non può prescindere dal confronto con le realtà esistenti al mondo. Entrambi i tavoli stanno conducendo revisioni sistematiche della letteratura volte a censire a livello mondiale i registri nazionali attivi di pacemaker e defibrillatori e di dispositivi spinali con l’obiettivo di studiarne le variabili e verificare, sulla base delle migliori evidenze scientifiche, la consistenza degli MDS e delle tassonomie con i valori già definiti dagli esperti di registri analoghi.
Flusso informativo del RIPI
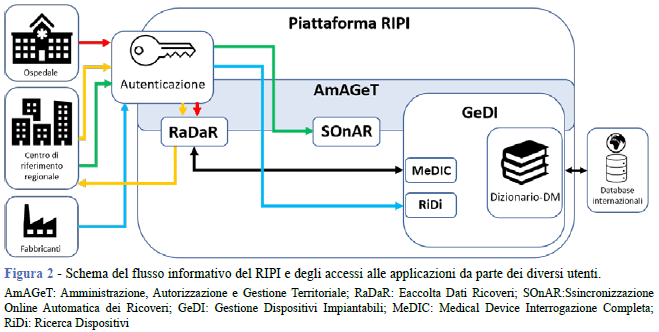
Per favorire la partecipazione delle Regioni, l’ISS offre una serie di applicazioni (Figura 2), già sperimentate e attive per il RIAP: RaDaR (Raccolta Dati Ricoveri), che supporta la raccolta dell’MDS e permette ai referenti regionali di monitorare le attività svolte nelle strutture partecipanti, e MeDIC (Medical Device Interrogazione Completa), per la consultazione del Dizionario dei dispositivi da parte degli operatori evitando così l’input manuale e, conseguentemente, riducendo notevolmente la possibilità di errori dovuti a un’errata digitazione. Sia MeDIC sia il Dizionario-DM fanno parte della componente GeDI (Gestione Dispositivi Impiantabili), di cui fa parte anche RiDi (Ricerca Dispositivi), che permette di integrare il Dizionario- DM in flussi applicativi esterni. Il Centro di Riferimento Regionale è il responsabile del processo di linkage dell’MDS con le SDO e della trasmissione all’ISS sia dei dati completi, attraverso l’applicazione SOnAR (Sincronizzazione Online Automatica dei Ricoveri), sia del numero totale di interventi effettuati utili per calcolare la completezza della registrazione a livello regionale e di singola struttura.
L’infrastruttura informatica del RIPI è progettata nel rispetto delle misure a protezione dei dati personali dei pazienti e degli operatori che vi accedono per inserire i dati. I dati anagrafici dei pazienti sono pseudonimizzati mediante l’applicazione di tecniche crittografiche sui dati identificativi. In questo modo il RIPI può svolgere la propria missione di tracciabilità e sorveglianza senza identificare direttamente i pazienti, che possono invece essere rintracciati, in caso di necessità, attraverso la collaborazione degli altri soggetti compartecipanti al progetto. In attesa della pubblicazione del Regolamento previsto dal DPCM, la raccolta dati è possibile previa acquisizione del consenso informato dei pazienti realizzato con la produzione di un documento di “informazioni” e una modulistica dedicata (16).
Nel caso del RIAP, i dati raccolti dalle Regioni sono sottoposti a un rigoroso controllo di qualità che ne verifica il rispetto delle regole sintattiche e la consistenza semantica. I dati ricevuti e registrati nel Dizionario-DM sono verificati attraverso una comparazione con le informazioni presenti nell’Open data della Banca dati dei dispositivi medici del Ministero della Salute. Tali procedure verranno estese e adattate anche agli altri registri.
Per dare particolare importanza al mantenimento di elevati standard di qualità, la progettazione ha seguito un approccio data quality first utilizzando una rappresentazione dei dati strutturata, basata sul formato XML (eXtensible Markup Language). Tale scelta permette non solo di formalizzare la struttura dei dati, in maniera che ogni informazione sia contrassegnata da tag descrittivi e caratterizzata da domini ben precisi, e di automatizzare i controlli di qualità, ma anche di supportare agevolmente l’interoperabilità con altri flussi istituzionali che attualmente, a livello nazionale, hanno adottato il formato XML per lo scambio di dati.
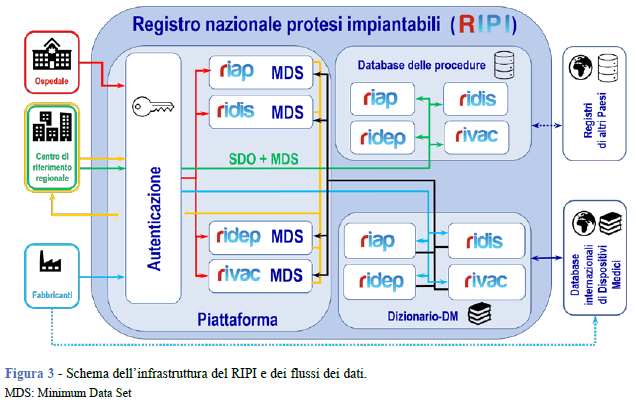
L’architettura della piattaforma di raccolta dati del RIPI (Figura 3) è stata disegnata per:
- evolvere verso una struttura modulare interamente basata su cloud che possa supportare l’accesso da parte di un numero crescente di partecipanti;
- predisporre l’integrazione dell’infrastruttura RIPI nell’ambito dei flussi istituzionali;
- automatizzare i controlli di qualità dei dati;
- supportare la collaborazione con altri registri, per le protesi ortopediche NJR (National Joint Registry - UK) e EPRD (EndoProthesenRegister Deutschland), al fine di condividere informazioni tecniche sulle caratteristiche dei dispositivi impiantati e integrare, nel Dizionario-DM, le informazioni necessarie alla loro caratterizzazione.
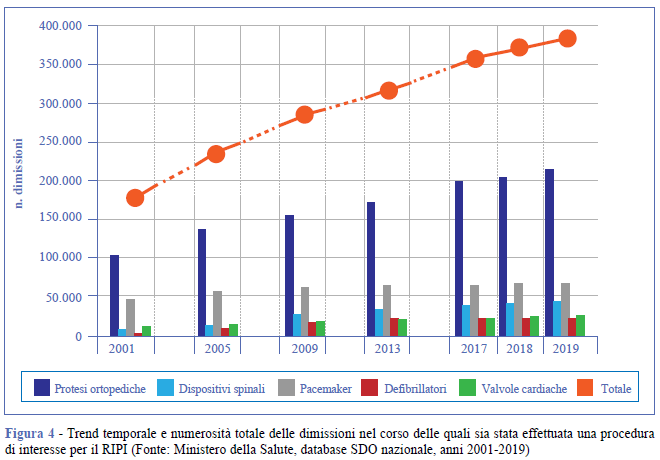
“Dimensioni” del RIPI e suo impatto sulla spesa sanitaria
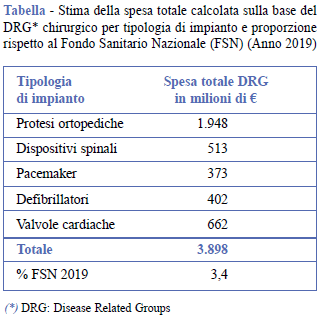
Il numero di dimissioni per le procedure considerate dal RIPI è raddoppiato nell’arco degli ultimi 19 anni (+115%) e nel 2019 sono state oltre 380.000. In assoluto, il numero più elevato di dimissioni ha riguardato gli interventi di impianto di protesi ortopediche, seguiti dall’impianto di pacemaker, di dispositivi spinali, di valvole cardiache e di defibrillatori impiantabili. L’incremento maggiore è stato registrato negli impianti di defibrillatori (+669%) seguiti dagli impianti di dispositivi spinali (+425%) (Figura 4). L’impatto sulla spesa sanitaria, per l’anno 2019, considerando il solo DRG chirurgico, è stimabile in circa 4 miliardi di Euro, pari al 3,4% del Fondo Sanitario Nazionale (Tabella).
Il sito web
L’architettura del sito web del RIPI (ripi.iss.it), attivo da dicembre 2019, riflette l’infrastruttura del RIPI comprendendo i sottositi specifici di ciascun registro con la flessibilità necessaria per accoglierne altri. Per enfatizzare la funzione del messaggio comunicativo e divulgativo, la sua struttura e l’impostazione grafica sono state definite insieme a professionisti in materia di comunicazione digitale. La sua costruzione si è basata sui principi già applicati nell’ideazione del sito del RIAP (riap.iss.it/riap/it/), considerando quindi anche rubriche che rispondono agli interessi dei principali tipi di utenza, un linguaggio comune nei contenuti delle pagine e un’ampia disponibilità di materiale di approfondimento per i professionisti del settore. La versione in lingua inglese permette al RIPI di vantare una posizione anche nel contesto scientifico internazionale.
Conclusioni
In Italia, come nel resto del mondo, il numero di interventi che riguardano l’impianto di dispositivi medici è in costante crescita. Nell’arco di un ventennio, le dimissioni ospedaliere relative agli interventi attualmente considerati dal RIPI sono più che duplicate e, nel 2019, il loro impatto sulla spesa sanitaria è stato superiore al 3%.
Risulta quindi evidente la necessità di disporre, come già avviene in altri Paesi, di uno strumento che permetta di tutelare la salute dei pazienti. I risultati delle analisi statistiche di sopravvivenza prodotte dal RIPI potranno supportare il Ministero della Salute nell’attività di vigilanza sui dispositivi medici e le aziende biomediche nel monitoraggio della qualità dei propri prodotti, come richiesto dal Regolamento EU 2017/745; permetteranno inoltre di partecipare al benchmarking internazionale delle protesi, contribuendo così alla segnalazione precoce di eventuali eventi avversi.
Un limite dell’attuale architettura del RIPI è insito nel modello di raccolta dati che, essendo basato sulle SDO, traccia esclusivamente le procedure di impianto che richiedono un ricovero ospedaliero. Tale modello non permetterebbe, quindi, di tracciare quelle tipologie di protesi che vengono impiantate in regime ambulatoriale sia pubblico sia privato. Tra queste, ad esempio, gli impianti dentali, il cui utilizzo è aumentato in modo importante nel corso degli anni, per i quali andrebbe studiato un modello diverso, simile a quello messo a punto per il Registro degli impianti protesici mammari (17). Inoltre, va evidenziato che, poiché il tavolo del Registro Italiano delle Valvole Cardiache (RIVAC) non è stato ancora avviato, non è stato possibile avvalersi degli esperti per la selezione dei codici ICD9-CM identificativi degli interventi di interesse, necessari per l’interrogazione delle SDO. Pertanto, i dati presentati vanno considerati con cautela, perché potrebbero non essere esaustivi o affetti da bias di selezione. La selezione, infatti, è stata limitata agli interventi codificati con solo uno dei codici ICD9-CM della classe 35.2X, senza considerare quindi le combinazioni con altri codici, che invece potrebbero essere state utilizzate dagli operatori nella compilazione della SDO per descrivere altri interventi di interesse. Analoga considerazione va fatta per la stima dell’impatto sulla spesa sanitaria, per il cui calcolo sono state prese a riferimento le tariffe DRG nazionali attualmente disponibili sul sito del Ministero della Salute pubblicate nel 2013. Poiché le singole Regioni determinano i propri livelli tariffari, potrebbero esserci in realtà scostamenti rispetto ai valori presi a riferimento. Il calcolo deve essere quindi inteso con il mero scopo di fornire l’ordine di grandezza della spesa.
Il RIPI è una realtà poliedrica. Un sistema ingegneristico di raccolta e analisi dei dati sanitari, un contenitore, la cui identità è la somma dei termini, ovvero dei singoli Registri che ne fanno parte. È anche un gruppo di ricerca che, al fine di tutelare i pazienti, produce risultati fruibili dai vari stakeholder. Tutti questi aspetti del RIPI sono rilevanti per i diversi tipi di pubblico a cui sono indirizzati (target groups). La logica del funzionamento del RIPI prevede una continua interazione con i diversi stakeholder, ognuno portatore di interessi e aspettative. Ogni Registro che ne fa parte interagisce con una moltitudine di soggetti: i medici specializzati nei rispettivi ambiti (prevalentemente i chirurghi), il Ministero della Salute (DG Dispositivi Medici e Servizio Farmaceutico), le autorità sanitarie regionali, le società scientifiche, i pazienti, le aziende produttrici dei dispositivi medici, i professionisti dell’informatica, solo per elencarne alcuni.
Metaforicamente, oggi ci troviamo di fronte a un grande cantiere che, per il momento, è dedicato alla costruzione di quattro edifici. La struttura di uno di questi, il RIAP, è completata ed è parzialmente popolata in alcune Regioni con gradi di completezza elevati e serie storiche di ormai 10 anni che permettono già di effettuare le prime analisi di sopravvivenza (11). L’auspicio è che presto le altre Regioni aderiscano in modo da disporre di un registro nazionale completo. Per gli altri edifici, RIDEP e RIDIS, sono state poste le fondamenta. Nei prossimi mesi verranno finalizzate nel dettaglio e descritte in documenti formali le informazioni che dovranno essere raccolte, risultato indispensabile per procedere con la corretta progettazione e realizzazione della piattaforma di raccolta dati. Infine, verrà avviato il tavolo tecnico del RIVAC.
Lo sviluppo del RIPI è al passo con le migliori pratiche di altri Paesi in cui le autorità sanitarie stanno promuovendo la creazione di registri nazionali di ampia portata. In Germania, al termine del 2019, è stato istituito per legge il Registro degli impianti (Implantateregister Deutschland, IRD). Con l’obiettivo di “garantire elevati standard di qualità e sicurezza nell'assistenza sanitaria che prevede l’utilizzo di impianti”, l’IRD prende in esame otto tipologie di dispositivi: protesi ortopediche, protesi mammarie, valvole cardiache e altri impianti cardiaci, defibrillatori e pacemaker impiantabili, neurostimolatori, impianti cocleari, protesi spinali e stent (18). Nel Regno Unito, lo sviluppo di un registro nazionale dei dispositivi medici (Medical devices registry) è stato recentemente promosso dall’Healthcare Quality Improvement Partnership (HQIP), coordinatore dal 2003 del NJR (19). In entrambi i casi gli ideatori dei registri nazionali sottolineano che lo sviluppo di una realtà così complessa necessita di una costante collaborazione tra gli stakeholder.
Anche per il RIPI, l’attiva collaborazione tra i vari attori è stata la chiave di volta che ha portato al raggiungimento di questi primi risultati. L’obiettivo è ora realizzare un sistema che, integrato nel Servizio Sanitario Nazionale, permetta il richiamo tempestivo dei pazienti nel caso di problemi alle protesi impiantate e sia in grado di monitorare la sicurezza dei dispositivi. Sarà così possibile rispondere a quanto richiesto dall’Europa e stabilito dalle normative nazionali, tutelando la salute dei pazienti con importanti positive ricadute anche sul contenimento della spesa sanitaria.
Ringraziamenti
Il RIPI è realizzato grazie al contributo assicurato dal Ministero della Salute, Direzione Generale dei Dispositivi Medici e del Servizio Farmaceutico. Gli autori ringraziano i colleghi della Segreteria tecnico-scientifica e amministrativa del Gruppo di Lavoro RIPI Mascia Masciocchi, Emanuela Saquella e Attanasio Cornacchia per il supporto fornito allo svolgimento dei progetti mirati alla realizzazione del Registro Italiano ArtroProtesi e del Registro Italiano delle Protesi Impiantabili.
Conflitti di interesse dichiarati: nessuno
Finanziamenti: nessuno
Authorship: tutti gli autori hanno contribuito in modo signifi cativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- Graves SE. The value of arthroplasty registry data. Acta Orthop. 2010 Feb;81(1):8-9. doi: 10.3109/17453671003667184
- International Medical Device Regulators Forum Patient Registries Working Group. Principles of International System of Registries Linked to Other Data Sources and Tools. IMDRF/REGISTRY WG/ N33FINAL:2016.
- Medicines and Healthcare products Regulatory Agency (MHRA). All metal-on-metal (MoM) hip replacements. Medical Device Alert MDA/2010/033 (22 April 2010).
- Medicines and Healthcare products Regulatory Agency (MHRA). DePuy ASR™ hip replacement implants. Medical Device Alert MDA/2010/069 (7 September 2010).
- Medicines and Healthcare products Regulatory Agency (MHRA). All metal-on-metal (MoM) hip replacements. Medical Device Alert MDA/2012/008 (28 February 2012).
- Italia. Legge 17 dicembre 2012, n. 221. Conversione in legge, con modificazioni, del decreto-legge 18 ottobre 2012, n. 179, recante ulteriori misure urgenti per la crescita del Paese. Gazzetta Ufficiale - Serie Generale n. 294, 18 dicembre2012 - Suppl. Ordinario n. 208.
- Unione Europea. Regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio. Gazzetta ufficiale dell'Unione Europea L 117, 5 maggio 2017.
- Italia. Decreto del Presidente del Consiglio dei Ministri del 3 marzo 2017. Identificazione dei sistemi di sorveglianza e dei registri di mortalità, di tumori e di altre patologie. Gazzetta Ufficiale - Serie Generale n. 109, 12 maggio 2017.
- Italia. Legge 30 dicembre 2018, n. 145. Bilancio di previsione dello Stato per l’anno finanziario 2019 e bilancio pluriennale per il triennio 2019- 2021. Gazzetta Ufficiale - Serie Generale n. 302, 31 dicembre 2018 – Suppl. Ordinario n. 62.
- Italia. Legge 22 marzo 2019, n. 29. Istituzione e disciplina della Rete nazionale dei registri dei tumori e dei sistemi di sorveglianza e del referto epidemiologico per il controllo sanitario della popolazione. Gazzetta Ufficiale - Serie Generale n. 81, 5 aprile 2019.
- Torre M, Carrani E, Ceccarelli S, Biondi A, Masciocchi M, Cornacchia A (Ed.). Registro Italiano ArtroProtesi. Report Annuale 2019. Roma: il Pensiero Scientifico Editore; 2020.
- Torre M, Ceccarelli S, Carrani E. Il Registro Italiano ArtroProtesi: uno strumento per potenziare la sicurezza dei pazienti. Not Ist Super Sanità - Inserto BEN 2019;32(10):i-v.
- Italia. Ministero della Salute. Decreto 18 ottobre 2012. Remunerazione prestazioni di assistenza ospedaliera per acuti, assistenza ospedaliera di riabilitazione e di lungodegenza post acuzie e di assistenza specialistica ambulatoriale. Gazzetta Ufficiale - Serie Generale n. 23, 28 gennaio 2013. All. 1. Tariffe delle prestazioni di assistenza ospedaliera per acuti, per tipo di ricovero (Euro). https://www.salute.gov.it/... ; ultimo accesso 6/7/2021.
- Iachino A, Viggiano G, Biffoli C, Brutti MC, Cecere E, Colliardo A, Stella E. Rapporto sulla spesa rilevata dalle strutture sanitarie pubbliche del SSN per l’acquisto di dispositivi medici. Anno 2019. Analisi dei dati rilevati attraverso il flusso informativo istituito con il decreto del Ministro della Salute 11 giugno 2010. Febbraio 2021. Versione 1.0. Roma: Ministero della Salute; 2021. https://www.salute.gov.it/...; ultimo accesso 6/7/2021.
- Proclemer A, Zecchin M, D’Onofrio A, Boriani G, Ricci RP. Registro Italiano Pacemaker e Defibrillatori. Bollettino Periodico 2018. Associazione Italiana di Aritmologia e Cardiostimolazione. G Ital Cardiol 2020;21(2):157-69. doi 10.1714/3300.32710
- Toccaceli V, Torre M. A far-reaching Regulation for the Italian National Registry of Implantable Prostheses: a possible model for other health registries. Ann Ist Super Sanità 2021;57(2):132-7. doi: 10.4415/ANN_21_02_04
- Campanale A, Boldrini R, Lispi L, Marletta M, Carrani E, Toccaceli V, Torre M. Box. 1.10. Il RIAP come riferimento per l’avvio dello studio pilota del Registro Nazionale delle Protesi Mammarie. In: Torre M, Carrani E, Ceccarelli S, Biondi A, Masciocchi M, Cornacchia A (Ed.). Registro Italiano ArtroProtesi. Report Annuale 2019. Roma: Il Pensiero Scientifico Editore; 2020.
- Implantateregistergesetz vom 12. Dezember 2019 (BGBl. I S. 2494), das zuletzt durch Artikel 7 des Gesetzes vom 14. Oktober 2020 (BGBl. I S. 2115) geändert worden ist. 12.12.2019. http://www.gesetze-im-internet.de... ; ultimo accesso 6/7/2021.
- Healthcare Quality Improvement Partnership (HQIP). Proposal for a medical devices registry. Full Report. 2020. https://www.hqip.org.uk/... ; ultimo accesso 6/7/2021.

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale