Valutazione post-marketing della sicurezza del vaccino antinfluenzale durante la campagna di vaccinazione antinfluenzale 2020-2021 in Italia: uno studio Self-Controlled Case Series sulla sindrome di Guillain-Barré
Stefania Spila Alegiania*, Cristina Morcianoa*, Valeria Belleudib, Francesca Romana Poggib, Patrizia Felicettic, Pasquale Marchionec, Fiorella Petronzellic, Loriana Tartagliac, Elena Clagnand, Rosa Ginie, Roberta Giordanaf, Stefano Fiorasog, Aurora Puccinih, Nehludoff Albanoi, Maria Cristina Carbonarai, Roberto Da Casa, Mauro Ruffierg, Ester Sapignih, Maria Parrillil, Giorgio Limoncellae, Marco Tuccorim, Roberto Bonaiutin, Lorella Lombardozzio, Nadia Moresp, Ugo Tramaq, Annalisa Capuanor, Massimo Di Gennarof, Maria Grazia Fumof, Domenica Anconas, Paolo Stellai, Silvio Tafurit, Pasquale Stefanizzit, Francesca Menniti Ippolitoa, Anna Rosa Marrac, Marco Massaria
(*) Gli autori hanno contribuito equamente
a Centro Nazionale per la Ricerca e Valutazione Preclinica e Clinica dei Farmaci, Istituto Superiore di Sanità, Roma
b Dipartimento di Epidemiologia del Servizio Sanitario Regionale del Lazio, Roma
c Area Vigilanza Post Marketing, Agenzia Italiana del Farmaco, Roma
d Azienda Regionale di Coordinamento per la Salute, Regione Autonoma Friuli Venezia Giulia, Udine
e Agenzia Regionale di Sanità, Regione Toscana, Firenze
f Società Regionale per la Sanità SPA, Regione Campania, Napoli
g Assessorato Sanità, Salute e Politiche Sociali, Regione Autonoma Valle d’Aosta, Aosta
h Servizio Assistenza Territoriale, Area Farmaco e Dispositivi Medici, Regione Emilia-Romagna, Bologna
i Dipartimento Promozione della Salute e del Benessere Animale, Regione Puglia, Bari
l Centro Regionale Toscano di Farmacovigilanza, Regione Toscana, Firenze
m Azienda Ospedaliera Universitaria di Pisa, Pisa
n Dipartimento di Neuroscienze, Psicologia, Area del Farmaco e Salute del Bambino, Università degli Studi di Firenze
o Area Farmaci e Dispositivi, Regione Lazio, Roma
p Fondazione Policlinico Universitario A. Gemelli IRCCS, Università Cattolica del Sacro Cuore, Roma
q Direzione Generale per la Tutela della Salute, Coordinamento Sistema Sanitario Regionale, Regione Campania, Napoli
r Centro Regionale di Farmacovigilanza e Farmacoepidemiologia, Regione Campania - Seconda Università degli Studi di Napoli
s Dipartimento Farmaceutico, ASL BT, Trani
t Dipartimento Interdisciplinare di Medicina, Università degli Studi di Bari Aldo Moro
Citare come segue: Spila Alegiani S, Morciano C, Belleudi V, Poggi FR, Felicetti P, Marchione P, Petronzelli F, Tartaglia L, Clagnan E, Gini R, Giordana R, Fioraso S, Puccini A, Albano N, Carbonara MC, Da Cas R, Ruffier M, Sapigni E, Parrilli M, Limoncella G, Tuccori M, Bonaiuti R, Lombardozzi L, Mores N, Trama U, Capuano A, Di Gennaro M, Fumo MG, Ancona D, Stella P, Tafuri S, Stefanizzi P, Menniti Ippolito F, Marra AR, Massari M. Valutazione postmarketing della sicurezza del vaccino antinfluenzale durante la campagna di vaccinazione antinfluenzale 2020-2021 in Italia: uno studio Self-Controlled Case Series sulla sindrome di Guillain-Barré. Boll Epidemiol Naz 2022;3(2):1-9. DOI: https://doi.org/10.53225/BEN_042
Post-marketing safety evaluation of flu vaccine during the 2020-2021 flu vaccination campaign in Italy: a Self-Controlled Case Series study of Guillain-Barré syndrome
Introduction
The Istituto Superiore di Sanità and the Agenzia Italiana del Farmaco coordinate the project TheShinISS-Vax|Flu, a post-marketing “active” surveillance of influenza vaccines. We report the results of the investigation using the Self- Controlled Case Series (SCCS) design on influenza vaccine and Guillain-Barré syndrome in vaccinated population aged over than 6 months, during the influenza vaccine campaign 2020-2021 in Italy.
Materials and methods
A SCCS multi-regional study was carried out using linked data from Regional Health Care Registries of Valle d’Aosta, Friuli Venezia Giulia, Emilia-Romagna, Toscana, Lazio, Campania, and Puglia. Relative incidence of Guillain-Barré syndrome was estimated, comparing the exposure risk periods (0-41 days from the vaccination day, subdivided in six intervals) with the unexposed period.
Results
Among 5,804,630 vaccinated subjects, 100 events of Guillain-Barré syndrome were observed during the study period, and 31 events occurred in the 42-day period following the administration of influenza vaccine. Within the second and third week following vaccination, an association was found with relative incidence of 2.76 (95% CI 1.41-5.38) and 3.03 (95% CI 1.59-5.80) respectively, corresponding to a number of excess cases of 0.11 (0.05-0.14) and 0.13 (0.07-0.16) per 100,000 vaccinated.
Discussion and conclusions
Results from this large SCCS study indicated that influenza vaccination is associated with Guillain-Barré syndrome, but that events are rare. Influenza vaccination remains a valid preventive measure to respond to an important public health problem, taking into account that influenza is a risk factor for both Guillain-Barré syndrome and other well-known complications, such as hospitalization and mortality.
Key words: influenza vaccines; Guillain-Barré syndrome; post marketing surveillance
Introduzione
Con il diffondersi della pandemia in Italia, il Ministero della Salute, nella circolare riguardante le raccomandazioni per la stagione influenzale 2020- 2021, ha indicato di anticipare la vaccinazione antinfluenzale e di estendere le coperture vaccinali nella popolazione. Lo scopo è stato quello di evitare di sovraccaricare le strutture del Sevizio Sanitario Nazionale in previsione di una possibile co-circolazione dei virus influenzali e del virus SARS-CoV-2 e di agevolare la diagnosi differenziale resa difficoltosa dal quadro clinico somigliante di influenza e COVID-19 (1).
L’inclusione di una più ampia popolazione nel programma vaccinale, e quindi di gruppi di soggetti con caratteristiche diverse rispetto a quelle delle precedenti stagioni vaccinali, è uno scenario che rafforza l’importanza dell'attività di sorveglianza per la valutazione del profilo di sicurezza dei vaccini antinfluenzali commercializzati in Italia.
È in questo contesto che nel 2020, nell’ambito di una collaborazione decennale tra l’Istituto Superiore di Sanità (ISS) e l’Agenzia Italiana del Farmaco (AIFA), è stato condotto lo studio TheShinISS-Vax|Flu. Si tratta di uno studio osservazionale multiregionale, basato su fonti di dati sanitari correnti, che si propone di stimare il rischio di insorgenza di eventi avversi gravi, rari o di particolare interesse (Adverse Event of Special Interest, AESI) successivi alla vaccinazione antinfluenzale della stagione 2020-2021.
Lo studio, coordinato dal Reparto di Farmacoepidemiologia e Farmacosorveglianza del Centro Nazionale per la Ricerca e la Valutazione Preclinica e Clinica dei Farmaci dell’ISS e dall’Area Vigilanza Post Marketing dell’AIFA, è stato condotto anche grazie alla consolidata collaborazione con le Regioni che hanno fornito i dati relativi alla coorte dei vaccinati durante la campagna vaccinale 2020-2021.
In particolare, lo studio TheShinISSVax| Flu si avvale dell’esperienza del Reparto di Farmacoepidemiologia e Farmacosorveglianza dell’ISS nella conduzione di studi multi-database con l’applicativo open source TheShinISS (2-8), concepito e realizzato dai ricercatori dell’ISS (9). Attualmente la gestione di TheShinISS, incluso l’adattamento alle finalità di altri progetti nazionali, è a cura del gruppo tecnico TheShinISS Network* che coinvolge ricercatori dell’ISS, del Dipartimento di Epidemiologia della Regione Lazio (10) e delle università di Verona e di Messina (11).
La sindrome di Guillain-Barré è tra gli esiti oggetto di approfondimento dello studio TheShinISS-Vax|Flu. Si tratta di una grave patologia immunomediata del sistema nervoso periferico ed è la causa più frequente di paralisi flaccida acuta. L'incidenza globale varia tra 0,8 e 1,9 casi per 100.000 anni/persona. Sebbene i meccanismi patofisiologici non siano stati ancora del tutto chiariti, alcuni studi caso-controllo hanno posto la sindrome di Guillain-Barré in relazione con infezioni causate da agenti infettivi, quali Campylobacter jejuni, influenza A virus, Mycoplasma pneumoniae, Haemophilus influenzae. Tali infezioni potrebbero indurre in alcune persone una risposta aberrante delle difese immunologiche diretta verso i nervi periferici che è tipica della sindrome. Nel corso degli ultimi venti anni, è anche stata esplorata una possibile relazione tra sindrome di Guillain-Barré e somministrazione di vaccini quali potenziali induttori della risposta autoimmune (12). Diversi studi di coorte e Self-Controlled Case Series (SCCS), svolti nelle passate stagioni influenzali in diversi Paesi, inclusa l’Italia, hanno mostrato una possibile relazione anche con i vaccini antinfluenzali (13-20).
Il presente lavoro si propone come obiettivo quello di valutare l’associazione tra la sindrome di Guillain-Barré e la vaccinazione antinfluenzale nel corso della campagna di vaccinazione antinfluenzale 2020-2021 in Italia.
Materiali e metodi
Popolazione in studio
Sono stati inclusi tutti i soggetti con età maggiore di 6 mesi che avevano ricevuto la vaccinazione antinfluenzale nella stagione 2020-2021, in accordo con le raccomandazioni nazionali e con le delibere regionali relative all’obbligatorietà (1), identificati attraverso l’anagrafe vaccinale delle Regioni che hanno aderito allo studio: Valle d’Aosta, Friuli Venezia Giulia, Emilia-Romagna, Toscana, Lazio, Campania e Puglia. Ogni soggetto incluso nella coorte è stato seguito dal 1° ottobre 2020 fino al termine del periodo di studio, definito come la data di ultimo aggiornamento dei flussi sanitari di ogni Regione (Materiale aggiuntivo - Tabella 1).
Fonti dei dati
- Anagrafe vaccinale: sono stati estratti i dati relativi a tutte le vaccinazioni, antinfluenzali e non, effettuate dal 1° agosto 2020 all’ultima data di aggiornamento per identificare la coorte dei vaccinati con vaccino antinfluenzale (dal 1° ottobre 2020) e per acquisire informazioni sull’uso precedente e concomitante di altri vaccini (potenziali confondenti).
- Anagrafe assistiti: sono stati estratti i dati anagrafici dei soggetti vaccinati per acquisire le informazioni demografiche dei vaccinati, la durata dell’assistibilità e lo stato in vita all’ultima data di aggiornamento disponibile.
- Registro delle prescrizioni farmaceutiche: sono state acquisite informazioni sull’uso dei farmaci (Sistema di classificazione anatomico, terapeutico, clinico) nel periodo precedente alla vaccinazione per la caratterizzazione dei soggetti della coorte dal 1° ottobre 2019 all’ultima data disponibile.
- Registro delle schede di dimissione ospedaliera (SDO): sono stati identificati sia l’evento in studio (dal 1° ottobre 2019 all’ultima data disponibile) sia le comorbidità dei soggetti della coorte (dal 1° ottobre 2015 all’ultima data disponibile) (Classificazione delle malattie, dei traumatismi, degli interventi chirurgici e delle procedure diagnostiche e terapeutiche, 9a revisione - ICD-9-CM).
- Registro degli accessi al pronto soccorso (PS): è stato identificato l’evento in studio dal 1° ottobre 2019 all’ultima data disponibile (Classificazione delle malattie, dei traumatismi, degli interventi chirurgici e delle procedure diagnostiche e terapeutiche, 9a revisione - ICD-9-CM).
- Registro delle esenzioni: sono state acquisite informazioni sulle comorbidità dei soggetti della coorte all’ultima data di aggiornamento.
Disegno dello studio
TheShinISS-Vax|Flu è uno studio multidatabase di coorte basato su archivi sanitari regionali che utilizza un applicativo statistico-informatico (TheShinISS) (9). Attraverso TheShinISS è possibile condurre analisi distribuite in studi di farmacoepidemiologia multiregionali, in cui le Regioni partecipanti condividono un modello comune di dati (Common Data Model, CDM). Tramite l’applicativo è possibile a livello locale: a) caricare gli archivi necessari per lo studio; b) effettuare il controllo di qualità; c) identificare la popolazione in studio (coorte); d) effettuare il record linkage tra la coorte e gli archivi sanitari; e) creare il file di analisi pseudonimizzato (Figura 1).
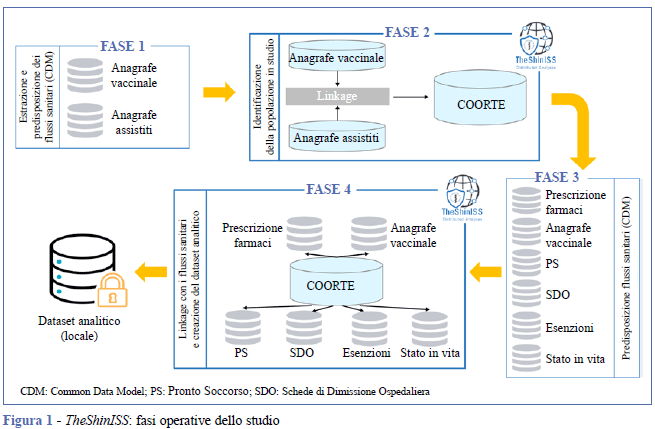
Per valutare l'associazione tra la vaccinazione antinfluenzale e la successiva insorgenza della sindrome di Guillain-Barré è stato utilizzato il metodo SCCS (21-23). Tale metodo è particolarmente adatto agli studi di sicurezza sulle vaccinazioni, soprattutto nel caso in cui la popolazione vaccinata abbia caratteristiche differenti rispetto alla popolazione non vaccinata o sia comunque difficile identificare un gruppo di confronto adeguato. Questo approccio richiede solo informazioni sugli individui che hanno sperimentato l'evento di interesse e permette di controllare per tutti i confondenti individuali che non variano nel tempo, anche quando questi sono non misurati o non noti. Originariamente disegnato per studiare l'associazione tra vaccinazione ed eventi specifici partendo dall’assunzione fondamentale che gli eventi non influenzino le successive esposizioni (ipotesi di esposizione evento-indipendente), il metodo è stato successivamente adattato a esposizioni eventodipendenti, ad esempio quando l’evento può precludere o semplicemente ritardare una qualsiasi esposizione successiva (24, 25). Questo si verifica negli studi sulla sicurezza dei vaccini quando l'evento di interesse rappresenta una controindicazione alla vaccinazione stessa.
Definizione degli esiti e caratterizzazione della coorte
L’evento in studio, sindrome di Guillain-Barré, insorto nel periodo di osservazione è stato identificato attraverso le diagnosi di dimissione dei ricoveri ospedalieri o degli accessi al PS (ICD- 9-CM 357.0). I casi sono stati definiti come coloro che hanno manifestato un primo evento (eventi incidenti) nel periodo di studio, escludendo dall'analisi i soggetti che hanno avuto un ricovero ospedaliero o un accesso al PS per l'evento in studio nei 365 giorni prima dell'inizio dello studio.
I soggetti vaccinati sono stati descritti per genere, età, area geografica, indice di Charlson basato sulle ospedalizzazioni nei 5 anni precedenti la vaccinazione, numero di ricoveri ospedalieri per qualsiasi causa nei due anni precedenti, numero di prescrizioni per qualsiasi farmaco nell’anno precedente la vaccinazione e comorbidità identificate attraverso gli archivi sanitari (SDO, prescrizioni farmaceutiche ed esenzioni) nel periodo precedente la vaccinazione (Materiale aggiuntivo - Tabella 2).
Definizione dell’esposizione
L’esposizione è stata quindi definita come la somministrazione di una prima o di una seconda dose di uno dei vaccini antinfluenzali disponibili in Italia durante la campagna vaccinale 2020-2021 (1). I vaccini sono stati classificati in tetravalenti, tetravalenti adiuvati MF59, tetravalenti vivi attenuati-spray nasale e trivalenti adiuvati MF59.
Il periodo di rischio è stato definito come 42 giorni dalla prima o dalla seconda dose di vaccinazione (0-41 giorni), suddiviso in sottoperiodi di rischio prespecificati: [0], [1-7], [8-14], [15-21], [22-28] e [29-41]. Il periodo di non esposizione (periodo di riferimento) è stato definito come il tempo di osservazione al di fuori del periodo di rischio.
Analisi statistica
Le caratteristiche demografiche e cliniche della coorte sono state descritte con mediana, interquartile range (IQR), frequenze e percentuali. Utilizzando il metodo SCCS “modificato per esposizioni evento-dipendenti” (24-26), sono state stimate le incidenze relative (IR) degli eventi in studio con i relativi intervalli di confidenza al 95% (IC 95%), nelle finestre di rischio prespecificate, attraverso delle unbiased estimating equations.
La teoria delle unbiased estimating equations generalizza quella degli stimatori di massima verosimiglianza ed è usata quando la funzione di verosimiglianza è difficile da ottenere. La precisione delle stime si può calcolare in modo simile a quelle del metodo di massima verosimiglianza (27). La componente stagionale (periodo di calendario) è stata inserita come covariata tempo-dipendente nel modello aggiustato. È stato infine stimato l'eccesso di casi (EC) per 100.000 vaccinati (28). L'analisi è stata eseguita utilizzando R 4.1.2 (R Core Team 2021) con la libreria SCCS (29) e STATA versione 17.
Risultati
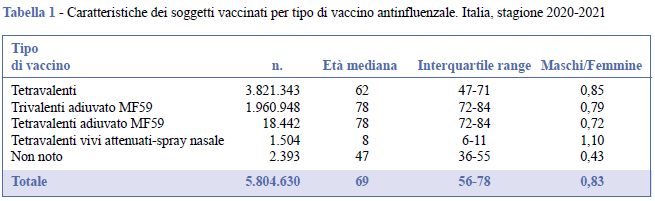
Durante il periodo ottobre 2020-gennaio 2021, nelle 7 Regioni partecipanti (popolazione di circa 29 milioni di assistiti), sono stati vaccinati 5.804.630 soggetti con il vaccino antinfluenzale, di cui 164.352 (2,8%) hanno ricevuto anche la seconda dose; il 55% entro il mese di ottobre, l’88% entro il mese di novembre e il 98% entro la fine del 2020. Il tempo mediano di follow up è stato di 170 giorni (IQR 149-193 giorni). Durante la campagna vaccinale antinfluenzale 2020-2021, nelle 7 Regioni in studio, sono stati utilizzati 13 diversi vaccini, 7 vaccini tetravalenti inattivati (n. 3.821.343, 65,8%), 2 vaccini trivalenti inattivati adiuvati (n. 1.960.948, 33,8%), 2 vaccini tetravalenti inattivati adiuvati (n. 18.442, 0,3%), 2 vaccini tetravalenti vivi attenuati-spray nasale (n. 1.504, 0,03%); per 2.393 (0,04%) soggetti non era noto il tipo di vaccino antinfluenzale somministrato. L’età mediana alla vaccinazione è stata di 69 anni (IQR 56-78 anni), il 7% aveva un’età inferiore a 18 anni e il 69% un’età superiore a 60 anni. Il rapporto maschi/femmine era pari a 0,83 (2.630.816 maschi e 3.173.814 femmine) (Tabella 1).
La copertura vaccinale complessiva, riferita alla popolazione Istat 2020 con età >6 mesi delle Regioni in studio, è stata del 23,5% e ha superato il 60% dopo i 70 anni, raggiungendo il 68% nella fascia sopra gli 80 anni e mostrando coperture superiori negli uomini (oltre il 70% sopra gli 80 anni). Le Regioni in studio hanno mostrato una copertura vaccinale che varia tra il 16,7% in Campania e il 27,8% in Toscana (Materiale aggiuntivo - Tabella 3). Nel Materiale aggiuntivo - Tabella 4 sono riportate le caratteristiche cliniche dei soggetti vaccinati stimate attraverso i dati degli archivi delle prescrizioni farmaceutiche, delle SDO e delle esenzioni nel periodo precedente la vaccinazione. Tra le patologie prese in considerazione, per le quali i vaccinati hanno avuto almeno un ricovero o accesso al PS nei 5 anni precedenti la vaccinazione, la più frequente è stata l’ipertensione (57,8%), seguita dalla broncopneumopatia cronico ostruttiva (18,1%), dal diabete (16,4%), dalle patologie cerebrovascolari (14,6%) e dai tumori (11,9%). Come atteso, nei soggetti vaccinati con età superiore a 60 anni si è osservato un incremento della maggior parte delle condizioni.
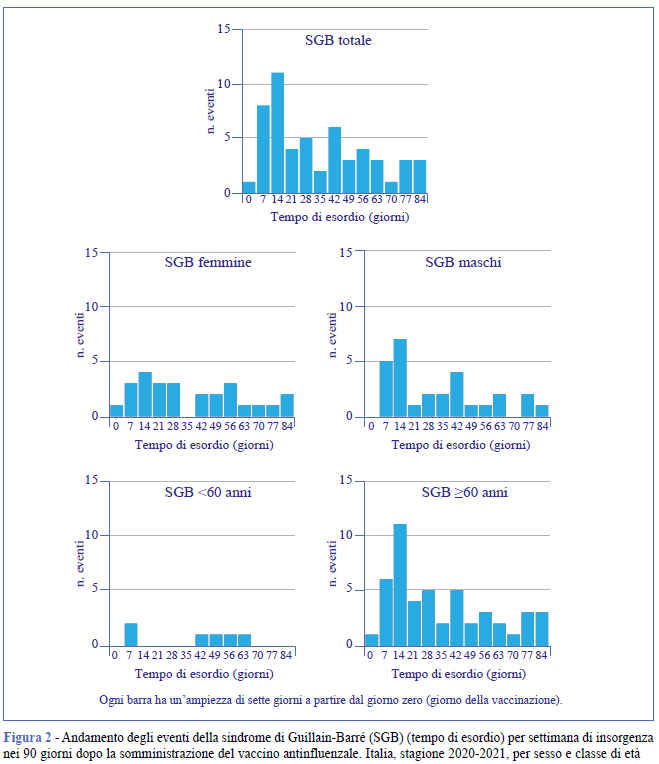
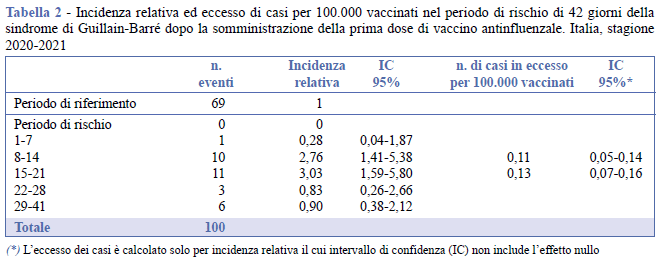
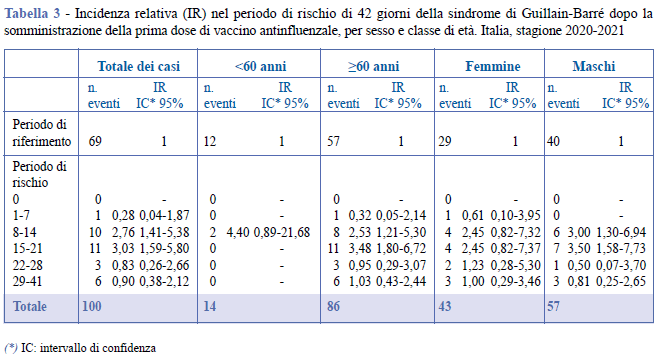
Durante il periodo considerato sono stati osservati 100 casi di sindrome di Guillain-Barré. L’andamento di questi eventi nei 90 giorni successivi alla vaccinazione è riportato nella Figura 2. Nella Tabella 2 sono riportate le IR per i periodi di rischio prespecificati e il numero di casi in eccesso per 100.000 vaccinati. È stata stimata un’associazione nella seconda (IR = 2,76; IC 95%: 1,41-5,38; EC = 0,11 per 100.000 vaccinati) e terza settimana (IR = 3,03; IC 95%: 1,59-5,80; EC = 0,13 per 100.000 vaccinati) dopo la prima somministrazione del vaccino antinfluenzale. Nella Tabella 3 sono riportate le IR nei periodi di rischio per sesso e classe di età (<60 e ≥60 anni); l’analisi per sottogruppo conferma l’associazione osservata nell’analisi overall nella seconda e terza settimana.
Discussione e conclusioni
Questo ampio studio multiregionale è stato condotto in Italia nella stagione influenzale 2020- 2021 e ha analizzato i dati di circa 6 milioni di vaccinati per valutare l’associazione dei vaccini antinfluenzali con la sindrome di Guillain-Barré. Nella popolazione generale lo studio ha rilevato un’associazione tra la vaccinazione antinfluenzale e la sindrome di Guillain-Barré, sia nella seconda che nella terza settimana dalla somministrazione del vaccino. Questi risultati sono in accordo con quelli già osservati da diversi studi di coorte e SCCS svolti nelle passate stagioni influenzali in Europa e negli Stati Uniti (13-16). Confermano, inoltre, quelli di un precedente studio caso-controllo, condotto in Italia nella stagione 2010-2011, in cui per i vaccinati si è stimato un rischio 3,8 volte più elevato di sviluppare la sindrome Guillain- Barré entro le sei settimane dalla vaccinazione antinfluenzale (17). Alcuni studi non confermano, invece, un incremento di rischio di Guillain-Barré associato ai vaccini antinfluenzali, ma è possibile che le differenze osservate dipendano dal fatto che sono state considerate stagioni influenzali e campagne vaccinali diverse, con differenti composizioni dei vaccini e popolazioni diverse (18-20).
Uno dei punti di forza del presente studio è rappresentato dall’utilizzo di archivi sanitari correnti riferiti a una vasta area geografica e a un’ampia popolazione. Questo è stato possibile grazie al consolidato e produttivo rapporto di collaborazione dell’ISS e dell’AIFA con le Regioni e contestualmente all’utilizzo dell’applicativo statistico-informatico TheShinISS per la conduzione di analisi distribuite nell’ambito di studi multi-database costruiti su un modello comune di dati.
Nel complesso questo modello di studio si è dimostrato in grado di generare evidenze affidabili in tempo utile per informare decisioni regolatorie e cliniche per le stagioni successive, presentando i seguenti vantaggi: ha consentito la conduzione di uno studio di ampia dimensione che riguarda tutta la popolazione vaccinata delle Regioni in studio, elemento essenziale negli studi di farmacosorveglianza post registrativi nel momento in cui sono analizzati eventi rari o sottogruppi di popolazione; ha ridotto il carico di lavoro per la raccolta dei dati, riducendo i tempi di conduzione dello studio e ha permesso un più accurato controllo della qualità dei dati raccolti. Altro punto di forza dello studio riguarda la scelta del metodo di analisi SCCS che, basato sul confronto intra-persona, ha consentito di controllare per confondenti noti e non noti che non variano nel tempo.
Un limite dello studio è rappresentato dal fatto che il dato relativo all’evento osservato, ricavato attraverso le diagnosi di dimissione dei ricoveri ospedalieri o degli accessi al PS, non è stato validato attraverso la revisione delle cartelle cliniche. Per questa ragione non può essere esclusa una misclassificazione che potrebbe aver determinato una distorsione delle stime. Un ulteriore limite è costituito dal fatto che non è stato possibile acquisire informazioni riguardo la gravità dei singoli casi, senza operare una distinzione fra i casi con accesso al solo PS e i casi ospedalizzati inclusa la durata dell’ospedalizzazione. Inoltre, data la bassa numerosità degli eventi di Guillain- Barré osservati nel nostro studio, non è stato possibile effettuare ulteriori analisi di sottogruppo, come per particolari sottogruppi di popolazioni (grandi anziani, bambini, popolazione fragile ecc.) o per tipologia di vaccino.
I risultati di questo studio confermano che gli eventi di Guillain-Barré sono molto rari. Infatti, è stato stimato un eccesso di rischio pari a 0,11 e 0,13 per 100.000 vaccinati nella seconda e nella terza settimana dalla somministrazione del vaccino. Pertanto, tenendo conto che l’influenza è un fattore di rischio sia per la sindrome di Guillain- Barré (17, 20) sia per altre ben note complicanze, quali l’ospedalizzazione e la mortalità, il vaccino antinfluenzale rimane un valido strumento per rispondere a un importante problema di sanità pubblica. Nel contesto pandemico generato dal nuovo virus SARS-CoV-2, il vaccino antinfluenzale ha contribuito, insieme alle stringenti misure di prevenzione individuale applicate per contrastare il COVID-19, a contenere la diffusione dei virus influenzali nel corso della stagione 2020-2021 (30).
Conflitti di interesse dichiarati: nessuno.
Finanziamenti: Convenzione ISS-AIFA "Studio per misurare l'efficacia sul campo e la sicurezza del vaccino antinfluenzale stagionale in Italia” - Fasc. Y47.
Authorship: tutti gli autori hanno contribuito in modo signifi cativo alla realizzazione di questo studio nella forma sottomessa.
Comitato etico: Comitato etico dell’Istituto Superiore di Sanità, prot. PRE BIO CE 01.001 del 1° febbraio 2021.
Riferimenti bibliografici
- Ministero della Salute. Circolare “Prevenzione e controllo dell’influenza: raccomandazioni per la stagione 2020-2021”. www.trovanorme.salute.gov.it/...; ultimo accesso 28/6/2022.
- Trifirò G, Massari M, Da Cas R, Menniti Ippolito F, Sultana J, Crisafulli S, et al. Renin-Angiotensin-Aldosterone System Inhibitors and Risk of Death in Patients Hospitalised with COVID-19: A Retro-spective Italian Cohort Study of 43,000 Patients. Drug Saf 2020;43(12):1297-308. doi: 10.1007/ s40264-020-00994-5
- Spila Alegiani S, Crisafulli S, Giorgi Rossi P, Mancuso P, Salvarani C, Atzeni F et al. Risk of coronavirus disease 2019 hospitalization and mortality in rheumatic patients treated with hydroxychloroquine or other conventional disease-modifying anti-rheumatic drugs in Italy. Rheumatology 2021;60(SI):- SI25-36. doi: 10.1093/rheumatology/keab348
- Ferroni E, Giorgi Rossi P, Spila Alegiani S, Trifirò G, Pitter G, Leoni, et al. Survival of Hospitalized COVID-19 Patients in Northern Italy: A Population- Based Cohort Study by the ITA-COVID-19 Network. Clin Epidemiol 2020;12:1337-46. doi: 10.2147/CLEP.S271763
- Massari M, Spila-Alegiani S, Fabiani M, Belleudi V, Trifirò G, Kirchmayer U, et al. Association of Influenza Vaccination and Prognosis in Patients Testing Positive to SARS-CoV-2 Swab Test: A Large-Scale Italian Multi-Database Cohort Study. Vaccines 2021; 9(7):716. doi: 10.3390/vaccines9070716
- Trifirò G, Isgrò V, Ingrasciotta Y, Ientile V, L'Abbate L, Foti SS et al. Large-scale postmarketing surveillance of biological drugs for immune-mediated inflammatory diseases through an Italian distributed multi-database healthcare network: the VALORE Project. BioDrugs 2021;35(6):749-64. doi: 10.1007/s40259-021-00498-3
- Rosa AC, Marino ML, Finocchietti M, Poggi FR, Massari M, Spila Alegiani S, et al. Immunosuppressive therapy after solid organ transplantation in Italy: a pilot study of the CESIT project. XI Congresso Nazionale SISMEC. Bari, 15-18 settembre 2021. sismecbari2021.it/...; ultimo accesso 28/6/2022.
- Massari M, Spila Alegiani S, Morciano C, Spuri M, Marchione P, Felicetti P, et al. Post-marketing active surveillance of myocarditis and pericarditis following vaccination with COVID-19 mRNA vaccines in persons aged 12-39 years in Italy: a multi-database, self controlled case series study. MedRxiv. doi: 10.1101/2022.02.07.22270020
- Massari M, Spila Alegiani S, Da Cas R, Menniti Ippolito F. TheShinISS: un applicativo open-source per la conduzione di analisi distribuite in studi di farmacoepidemiologia di tipo multi-database. Boll Epidemiol Naz 2020;1(2):39-45. doi: 10.53225/BEN_006
- European Network of Centres for Pharmacoepidemiology and Pharmacovigilance. Comparative Effectiveness and Safety of Immunosuppressive Drugs in Transplant patients - CESIT project. www.encepp.eu...; ultimo accesso 28/6/2022.
- European Network of Centres for Pharmacoepidemiology and Pharmacovigilance. Post-marketing evaluation of the benefit-risk profile of originator biological drugs and biosimilars in the dermatological, rheumatological, gastroenterological and onco-hematological areas through the establishment of a single multiregional network for the integrated analysis of data from health databases, active surveillance and clinical registers - VALORE project. https://www.encepp.eu/...; ultimo accesso 28/6/2022.
- Willison HJ, Jacobs BC, van Doorn PA. Guillain-Barré Syndrome. Lancet 2016;388(10045):717-27. doi: 10.1016/S0140-6736(16)00339-1
- Salmon DA, Proschan M, Forshee R, Gargiullo P, Bleser W, Burwen DR, et al. Association between Guillain-Barré syndrome and influenza A (H1N1) 2009 monovalent inactivated vaccines in the USA: a meta-analysis. Lancet 2013;381(9876):1461-8; doi: 10.1016/S0140-6736(12)62189-8
- Centers for Disease Control and Prevention (CDC). Preliminary results: surveillance for Guillain-Barré syndrome after receipt of influenza A (H1N1) 2009 monovalent vaccine-United States, 2009-2010. Morb Mortal Wkly Rep 2010;59(21):657-61.26. PMID: 20520590
- Tokars JI, Lewis P, De Stefano F, Wise M, Viray M, Morgan O, et al. The risk of Guillain-Barré syndrome associated with influenza A (H1N1) 2009 monovalent vaccine and 2009-2010 seasonal influenza vaccines: results from self-controlled analyses. Pharmacoepidemiol Drug Saf 2012;21(5):546-52. doi: 10.1002/pds.3220
- Greene SK, Rett M, Weintraub ES, Li L, Yin R, Amato AA, et al. Risk of confirmed Guillain-Barré syndrome following receipt of monovalent inactivated influenza A (H1N1) and seasonal influenza vaccines in the vaccine safety datalink project, 2009– 2010. Am J Epidemiol 2012;175(11):1100-9. doi: 10.1093/aje/kws195
- Galeotti F, Massari M, D'Alessandro R, Beghi E, Chiò A, Logroscino G, et al. Risk of Guillain-Barré syndrome after 2010-2011 influenza vaccination. Eur J Epidemiol 2013;28(5):433-44. doi: 10.1007/ s10654-013-9797-8
- Grave C, Boucheron P, Rudant J, Mikaeloff Y, Tubert-Bitter P, Escolano S, et al. Seasonal influenza vaccine and Guillain-Barré syndrome: A self-controlled case series study. Neurology 2020;94(20):e2168-e2179. doi: 10.1212/ WNL.0000000000009180
- Grimaldi-Bensouda L, Alpérovitch A, Besson G, Vial C, Cuisset JM, Papeix C, et al. Guillain-Barre syndrome, influenza like illnesses, and influenza vaccination during seasons with and without circulating A/H1N1 viruses. Am J Epidemiol 2011;174(3):326-35. doi: 10.1093/aje/kwr072
- Ghaderi S, Gunnes N, Bakken IJ, Magnus P, Trogstad L, Håberg SE. Risk of Guillain-Barré syndrome after exposure to pandemic influenza A(H1N1)pdm09 vaccination or infection: a Norwegian population-based cohort study. Eur J Epidemiol 2016;31(1):67-72. doi: 10.1007/s10654-015-0047-0
- Whitaker HJ, Farrington CP, Spiessens B, Musonda P. Tutorial in biostatistics: the self-controlled case series method. Stat Med 2006;25(10):1768-97. doi: 10.1002/sim.2302
- Petersen I, Douglas I, Whitaker H. Self controlled case series methods: an alternative to standard epidemiological study designs. BMJ 2016;354:i4515. doi: 10.1136/bmj.i4515
- Weldeselassie YG, Whitaker HJ, Farrington CP. Use of the self-controlled case-series method in vaccine safety studies: review and recommendations for best practice. Epidemiol Infect 2011;139(12):1805-17. doi: 10.1017/ S0950268811001531
- Farrington CP, Whitaker HJ, Hocine MN. Case series analysis for censored, perturbed, or curtailed post-event exposures. Biostatistics 2009;10(1):3- 16. doi: 10.1093/biostatistics/kxn013
- Farrington CP, Whitaker H, Weldeselassie YG. Self-Controlled Case Series Studies. A Modelling Guide with R. Boca Raton (US): Chapman & Hall/CRC Press; 2018.
- Ghebremichael-Weldeselassie Y, Jabagi MJ, Botton J, Bertrand M, Baricault B, Drouin J, et al. A modified self-controlled case series method for event-dependent exposures and high event-related mortality, with application to COVID-19 vaccine safety. Stat Med 2022;41(10):1735-50. doi: 10.1002/sim.9325
- Cox DR, Unbiased estimating equations derived from statistics that are functions of a parameter, Biometrika 1993;80(4):905-9. doi: 10.1093/biomet/ 80.4.905
- Wilson K and Hawken S. Drug safety studies and measures of effect using the self-controlled case series design. Pharmacoepidemiol Drug Saf 2013;22(1):108-10. doi: 10.1002/pds.3337
- Weldeselassie YJ, Whitaker H and Farrington P. SCCS: The Self-Controlled Case Series Method. R. package version 1.5. 2021. sccs-studies.info/r.html; ultimo accesso 7/7/2022.
- Greco D, Rizzo C, Puzelli S, Caraglia A, Maraglino F, Bella A. L’impatto dei virus influenzali in Italia nella stagione 2020-21 durante la pandemia di COVID-19. Boll Epidemiol Naz 2021;2(2):1-6. doi: 10.53225/BEN_013
(*) Componenti del TheShinISS Network
Marco Massari, Stefania Spila Alegiani, Roberto Da Cas (Istituto Superiore di Sanità, Roma); Gianluca Trifirò, Luca L’Abbate, Matilde Tanaglia (Università di Verona); Valentina Ientile, Ylenia Ingrasciotta (Università di Messina); Valeria Belleudi, Alessandro De Rosa, Marco Finocchietti, Francesca Romana Poggi (Dipartimento di Epidemiologia del Servizio Sanitario Regionale del Lazio, Roma); Andrea Fontana (IRCCS Casa del Sollievo e della Sofferenza, San Giovanni Rotondo).

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale