Meningiti, meningo-encefaliti ed encefaliti da virus Toscana in Italia, 2016-2021: punta dell’iceberg di una arbovirosi endemica poco conosciuta
Flavio Mellacea,b, Martina Del Mansob, Aurea Oradini-Alacreub,c, Emiliano Ceccarellib, Alberto Mateo-Urdialesb, Daniele Petroneb, Antonino Bellab, Maria Grazia Caporalib, Gioia Bongiornob, Ilaria Bernardinib, Marco Di Lucab, Giulietta Venturib, Claudia Fortunab, Stefania Giannitellib, Federica Ferrarod, Francesco Maraglinod, Patrizio Pezzottib, Flavia Riccardob e la Rete dei referenti regionali per le arbovirosi*
a Dipartimento di Area Medica, Università degli Studi di Udine
b Dipartimento Malattie Infettive, Istituto Superiore di Sanità, Roma
c Scuola di Specializzazione in Igiene e Medicina Preventiva, Università Vita-Salute San Raffaele, Milano
d Direzione Generale della Prevenzione, Ministero della Salute, Roma
Citare come segue: Mellace F, Del Manso M, Oradini-Alacreu A, Ceccarelli E, Mateo-Urdiales A, Petrone D, Bella A, Caporali MG, Bongiorno G, Bernardini I, Di Luca M, Venturi G, Fortuna C, Giannitelli S, Ferraro F, Maraglino F, Pezzotti P, Riccardo F e la Rete dei referenti regionali per le arbovirosi. Meningiti, meningoencefaliti ed encefaliti da virus Toscana in Italia, 2016-2021: punta dell’iceberg di una arbovirosi endemica poco conosciuta. Boll Epidemiol Naz 2022;3(2):10-19. DOI: https://doi.org/10.53225/BEN_043
Toscana virus meningitis, meningo-encephalitis and encephalitis in Italy, 2016-2021: the tip of the iceberg of a poorly known endemic arbovirus
Introduction
Toscana virus (TOSV) is an emerging pathogen, however it is seldom considered by physicians among the differential diagnoses of summer meningitis, leading to under-ascertainment. The aim of this study is to describe cases of laboratory confirmed TOSV central nervous system (CNS) infections, notified in Italy in the period 2016-2021.
Materials and methods
We described all cases of meningitis/meningo-encephalitis/encephalitis notified to the Italian national TOSV surveillance system from 2016 to 2021. All cases were laboratory-confirmed. We calculated incidence (overall, stratified by year, sex, age group and by municipal urbanization level) and the frequency of hospitalizations and deaths.
Results
Between June 2016 and October 2021, 331 confirmed cases of TOSV meningitis/meningo-encephalitis/ encephalitis were reported in Italy (median 56 cases/year) of whom 292 were hospitalized. The cases were reported in 9/21 Italian Regions with the highest incidence in rural municipalities. Average age was 46 (range 0-89 years), most cases were male (233, 70%). An increased notification rate was observed in 2018 when incidence (1.47 cases/1,000,000) was almost twice the mean incidence in the remaining study period (0.81 cases/1,000,000). Overall, incidence was higher in age groups between 20 and 59 years. In 2020-2021 no deaths were reported.
Discussion and conclusions
The number of human infections caused by TOSV in Italy is under-estimated and diverse testing policies may bias the observed case distribution. Higher incidences in working age males and in rural municipalities might point to specific risk factors, also occupational. While no deaths were recently reported, TOSV impacts on hospital services.
Key words: surveillance; arboviruses; Toscana virus; emerging viruses; neuroinvasive diseases
Introduzione
Il virus Toscana (TOSV) è un arbovirus provvisto di pericapside, con genoma a RNA tri-segmentato, appartenente al genere Phlebovirus, famiglia Bunyaviridae e all’ordine dei Bunyavirales (1) che è trasmesso da flebotomi, ditteri ematofagi appartenenti alla famiglia Psychodidae. Studi genetici hanno rilevato l'esistenza di tre lignaggi di TOSV (A, B e C). A oggi, non è nota alcuna correlazione tra virulenza o manifestazioni cliniche nell’uomo e lignaggio genetico (2).
Il periodo di incubazione della malattia è solitamente di 3-7 giorni, ma può durare fino a 2 settimane (3) ed è correlato con la carica virale della puntura infettante. La maggior parte delle infezioni umane da TOSV decorre in maniera asintomatica o paucisintomatica. Le manifestazioni cliniche più frequentemente descritte sono: febbre, cefalea, nausea/vomito, con esordio improvviso, che tendono ad autorisolversi in media dopo circa 7 giorni (4, 5) senza bisogno di assistenza medica e sono, quindi, raramente diagnosticate.
Nelle forme più gravi, il TOSV, a causa del suo neurotropismo, può provocare malattie neuro-invasive nell’uomo. Oltre alla meningite e meningo-encefalite, descritte storicamente, sono state anche descritte neuropatie periferiche (ad esempio, la sindrome di Guillain-Barré, le poliradiculomielopatie) e dei nervi cranici (sordità e paralisi facciale). Sebbene la malattia possa essere grave, il riscontro di sequele a lungo termine o di decessi è molto raro (4).
Pur essendo una delle cause preminenti di meningiti/meningo-encefaliti estive nei Paesi del Mediterraneo e una malattia emergente (5-7), TOSV è raramente considerato nella diagnosi differenziale delle infezioni del Sistema Nervoso Centrale (SNC), portando a una sottodiagnosi dell'infezione. Contestualmente, l’interesse scientifico per questo arbovirus è minore rispetto ad altri (ad esempio, il virus West Nile, Chikungunya, Dengue) ed è associato a una produzione scientifica molto più limitata (8). Infine, la mancanza di una sorveglianza internazionale limita le conoscenze in merito alla diffusione di questo patogeno e al suo impatto sulla salute umana (5).
La diffusione del TOSV dipende dalla presenza e dall'abbondanza dei suoi vettori. La trasmissione all’uomo o ad altri animali avviene durante il pasto di sangue di flebotomi femmine, tipicamente tra maggio e ottobre. Anticorpi anti TOSV sono stati trovati, oltre che nell’uomo, in cavalli, gatti, cani, pecore, maiali, bovini e pipistrelli (9). Non vi sono evidenze solide circa la presenza di reservoir dell’infezione e l’uomo è considerato un ospite terminale. Per questo motivo, considerando il lungo intervallo di inattività del vettore nel periodo autunno-invernale, non è chiaro il meccanismo di mantenimento a lungo termine di questo virus (8).
In Italia, Phlebotomus perniciosus è la specie di vettore predominante, particolarmente presente nelle aree rurali e in quelle periurbane delle regioni tirreniche e meridionali che si trovano ad alta e bassa quota (1.070-17 m) (10); tale specie è seguita da Phlebotomous perfiliewi. Quest’ultima raggiunge la più alta densità sul versante adriatico degli Appennini, dall’Abruzzo all’Emilia-Romagna. Altri focolai ad alta densità di questa specie si ritrovano in Toscana, Calabria e Sicilia, dove sono stati reperiti fino a un’altitudine di 1.147 m (11). L’andamento stagionale dei casi di TOSV risente di diversi fattori che vanno dai processi di urbanizzazione a quelli metereologici. I cambiamenti climatici influiscono sulla distribuzione geografica di molte specie di flebotomi che si sono diffuse nell’ultimo decennio anche nel Nord Europa (12).
Il TOSV è stato isolato per la prima volta da P. perniciosus nell'Italia centrale (Toscana) nel 1971 (13); in seguito, l'infezione da TOSV è stata segnalata in viaggiatori di ritorno provenienti dall’Italia e da altri Paesi del Mediterraneo (14-16). Negli ultimi due decenni, la circolazione di TOSV è stata rilevata soprattutto nel bacino del Mediterraneo e studi di sieroprevalenza hanno evidenziato un'elevata e diffusa esposizione nell’uomo, con un gradiente che aumenta con l’età, e negli animali domestici (17-22). La distribuzione del TOSV comprende Paesi dell’Europa meridionale (Italia, Spagna, Francia, Portogallo), del Mediterraneo Orientale (Turchia, Cipro), della penisola Balcanica (Grecia, Croazia, Bosnia ed Erzegovina, Kosovo, Bulgaria) e del Nord Africa (Tunisia, Marocco, Algeria) (2, 5, 23).
L’obiettivo di questo studio è di descrivere i casi di infezione del SNC da TOSV, notificati in Italia dal sistema di sorveglianza nazionale nel periodo 2016- 2021, illustrandone la distribuzione geografica nel tempo e l’impatto sui servizi assistenziali.
Materiali e metodi
In Italia, la segnalazione delle infezioni da TOSV nell’uomo è stata prevista per la prima volta, nel 2016, in una Circolare del Ministero della Salute tra gli “altri arbovirus per i quali si raccomanda la segnalazione in caso di diagnosi”. Tale raccomandazione non si accompagnava a una definizione di caso e avveniva tramite una scheda di segnalazione generica inviata via e-mail/fax (24). I dati ricevuti venivano inseriti manualmente in un database (Microsoft Corporation, Redmond, USA) presso l’Istituto Superiore di Sanità (ISS). Tra il 2016 e il 2017, numerose Regioni/Province Autonome (PA) hanno iniziato a inviare segnalazioni di casi di malattia da TOSV, prevalentemente meningiti e meningo-encefaliti. Questo ha permesso, dal 2018, di iniziare a produrre schede epidemiologiche sintetiche sulla malattia neuro-invasiva da TOSV durante le stagioni di maggiore circolazione del vettore e di renderle pubblicamente disponibili (25).
La sorveglianza delle infezioni da TOSV è stata inclusa nel Piano Nazionale di prevenzione, sorveglianza e risposta alle Arbovirosi 2020-2025 (PNA) realizzato dal Ministero della Salute con il supporto dell'ISS e di esperti delle Regioni e PA (26), in cui sono stati definiti i criteri clinici e di laboratorio da considerare per la definizione dei casi probabili e confermati di infezione da TOSV (Tabella 1). In tale occasione, è stata definita una scheda di sorveglianza specifica per la malattia neuro-invasiva da TOSV e nel 2020 è stata realizzata una piattaforma online per la segnalazione diretta da parte delle Regioni e PA, integrata con quella già operativa per le altre arbovirosi sotto sorveglianza.

La sorveglianza dei casi di infezione umana da TOSV è attiva tutto l’anno, sebbene si intensifichi durante il periodo di maggiore attività vettoriale. Ogni anno, alla fine di ogni stagione di trasmissione, le Regioni/PA rivalutano e integrano i dati segnalati in modo da migliorarne complessivamente qualità e completezza.
La sorveglianza dei casi umani di infezione da TOSV raccoglie dal 2016 informazioni riguardanti i dati anagrafici, la presentazione clinica (febbre, artralgie, astenia, cefalea, mialgia, dolore retroorbitale, rash cutaneo, poliradicoloneurite, paralisi facciale, febbre emorragica e altri sintomi riportati dal segnalante ma non elencati nella scheda di sorveglianza), il ricovero, il luogo di più probabile esposizione e gli esami di laboratorio realizzati sui campioni prelevati. In base a queste informazioni, un caso viene classificato come confermato o probabile (Tabella 1). Inoltre, un caso viene identificato come autoctono o importato in base al luogo di più probabile esposizione, rispettivamente in Italia o all’estero. Dal 2020, vengono raccolti in modo sistematico dati sull’esito dell’infezione acquisiti durante il ricovero (deceduto, grave, in via di miglioramento, guarito, non noto).
Ai fini di questo studio, sono stati selezionati tutti i casi di infezione confermata da TOSV segnalati al sistema di sorveglianza nazionale dal mese di giugno 2016 al mese di dicembre 2021 (sei stagioni di trasmissione vettoriale), che soddisfacevano il criterio clinico di infezione del SNC (meningite, meningo-encefalite o encefalite). Non sono state considerate forme non invasive riportate o altre forme neuro-invasive, in quanto verosimilmente meno soggette ad accertamento diagnostico. Sono stati quindi estratti i dati dai due database TOSV disponibili a livello nazionale, il primo compilato manualmente in ISS (relativo al periodo 2016- 2019) e il secondo successivo alla realizzazione della piattaforma di sorveglianza online (relativo al periodo 2020-2021), allineando le variabili comuni a entrambi i dataset per realizzare un database unico per l'intero periodo di studio.
È stata calcolata la frequenza dei casi distribuiti per età, sesso e quella di ricovero in ospedale per descrivere l’impatto osservato sui servizi assistenziali e l’esito. Abbiamo, inoltre, stimato l’incidenza di infezione da TOSV dell'SNC per sesso e fascia di età e descritto la distribuzione dei casi nel tempo mediante curve epidemiche. Per il calcolo dell'incidenza, al denominatore, sono stati utilizzati i dati del censimento Istat della popolazione residente al 1° gennaio degli anni 2016-2021 stratificata per sesso ed età (27). L’analisi è stata realizzata in Microsoft Excel versione 2022 per il periodo considerato. Per le variabili di esito, è stato considerato il solo periodo 2020-2021. Per migliorarne ulteriormente la qualità, è stato chiesto a tutte le Regioni/PA di verificare completezza, aggiornamento e correttezza dei dati di esito riportati. Questa verifica è stata realizzata tra il 10 e il 18 maggio 2022.
È stata realizzata un’analisi geografica per descrivere la diffusione dei casi nello spazio e i tassi di incidenza in relazione al livello di urbanizzazione dei Comuni ottenuto dal censimento del 2011 realizzato dall’Istat (28). Ogni caso è stato attribuito al Comune di probabile esposizione riportato nella scheda di sorveglianza, laddove disponibile. Quando non specificato, il caso è stato associato al Comune di domicilio. Le distribuzioni geografiche sono state stratificate segnalando la Regione italiana (NUTS2), per tenere conto delle differenze nei protocolli regionali di accertamento diagnostico. Le analisi geografiche sono state effettuate con il software R 4.2.0 tramite l’ambiente di sviluppo RStudio 2022.02.2.
Risultati
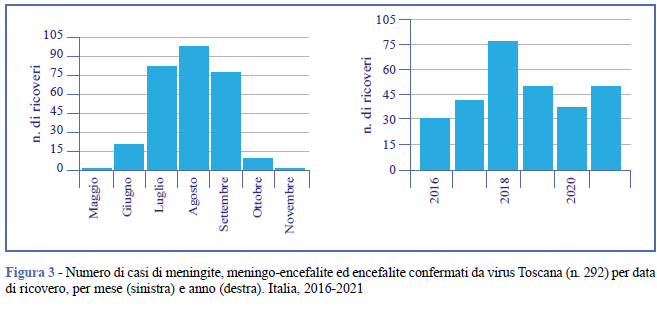
Nel periodo 2016-2021, in Italia, sono stati segnalati al sistema di sorveglianza 331 casi di infezioni confermate del SNC da TOSV con una mediana di 56 casi (range 35-89 casi) ogni anno. L’andamento dei casi è caratterizzato da una forte stagionalità (Figura 1) con esordio clinico prevalente nel periodo giugno-ottobre. Il picco delle segnalazioni è avvenuto nel 2018 con 89 casi, di cui 36 (40,4%) nel solo mese di agosto. L’incidenza media nel periodo 2016-2021 è stata di 0,92 casi per 1.000.000 abitanti. Escludendo il 2018, quando l’incidenza è stata di 1,47 casi per 1.000.000 abitanti, l’incidenza media è stata di 0,81 casi per 1.000.000 abitanti. Complessivamente, 324 casi (98%) erano indicati come autoctoni. Dei 7 casi rimanenti, per 4 era indicata una possibile associazione con un viaggio all’estero, per 3 casi l’informazione non era disponibile.
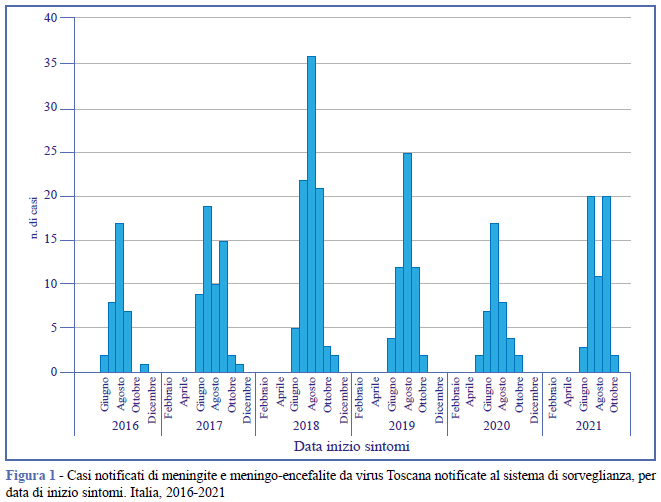
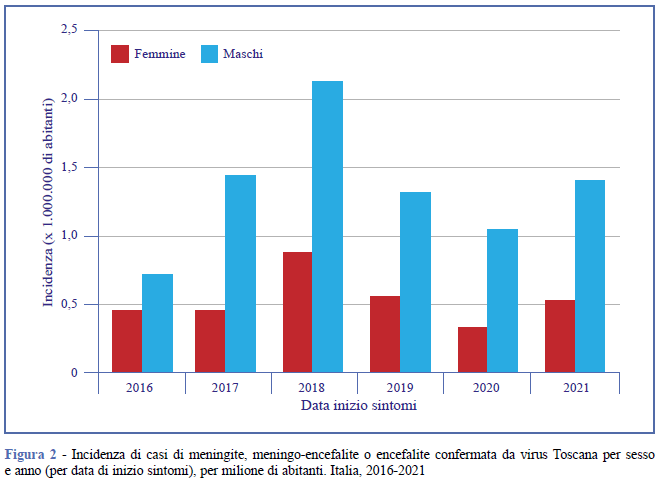
Come si evince dalla Tabella 2, la maggior parte dei casi riportati dal sistema di sorveglianza era di sesso maschile (n. 233, 70%). L’incidenza non ha mai superato un caso per milione di abitanti nelle persone di sesso femminile. Tra gli individui di sesso maschile, tale soglia è stata superata a partire dal 2017, con un picco di oltre 2 casi per milione di abitanti nel 2018 (Figura 2, Tabella 3).
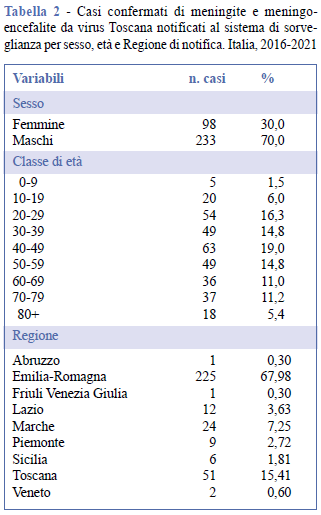
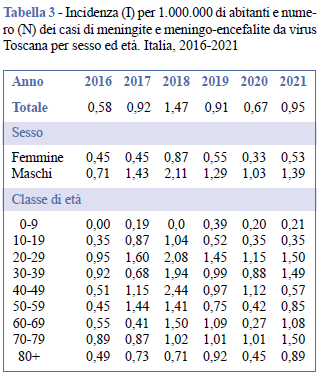
L’età mediana dei casi nel periodo 2016-2021 è stata di 46 anni (range 0-89 anni), con una maggiore frequenza e incidenza di casi nelle fasce di età comprese tra 20 e 59 anni (n. 215, 65,0%) (Tabella 2, Tabella 3).
In 292 casi (88,2%) è stata riportata una data di ricovero ospedaliero. I ricoveri ospedalieri documentati tra il 2016 e il 2021 si sono verificati prevalentemente tra i mesi di luglio e di settembre (Figura 3). In media sono stati riportati 49 ricoveri l’anno, con un picco di 78 ricoveri nel 2018. L’esito della malattia è stato riportato in 93 dei 96 casi segnalati nel 2020-2021 (96,9%). Durante questo periodo non sono stati documentati decessi, un caso è stato classificato come grave e 92 casi come guariti o in via di miglioramento.
La Tabella 2 e la Figura 4A mostrano rispettivamente le Regioni/PA italiane per numero e percentuale di casi segnalati e le Province in cui è stato segnalato almeno un caso nel periodo 2016-2021.
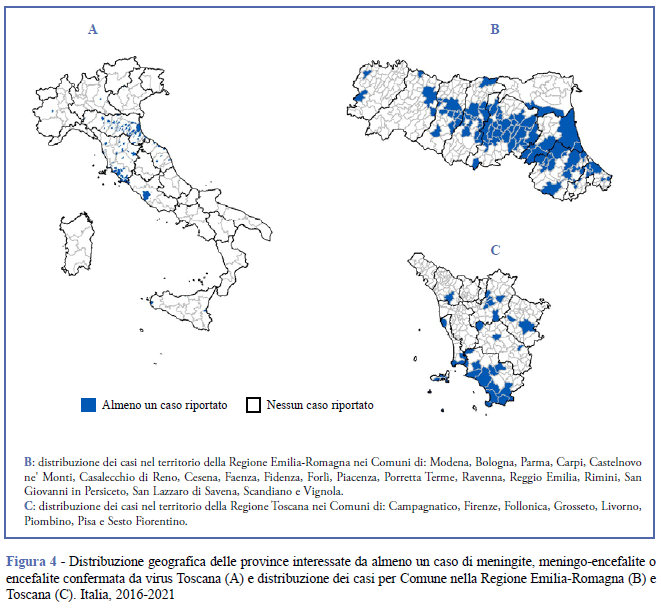
Si osserva come la maggior parte delle segnalazioni nel periodo di studio siano pervenute dalla Regione Emilia-Romagna (n. 225, 67,98%), seguita dalla Toscana (n. 51, 15,41%). Le Regioni che hanno riportato almeno un caso di meningite, meningo-encefalite o encefalite da TOSV nel periodo 2016-2021 sono nove: Abruzzo, Emilia-Romagna, Friuli Venezia Giulia, Lazio, Marche, Piemonte, Sicilia, Toscana e Veneto. Le Province interessate da almeno un caso si trovano prevalentemente nelle Regioni del Centro-Nord del Paese. La Figura 4 illustra la distribuzione dei casi per Comune nel territorio delle Regioni Emilia-Romagna (Figura 4B) e Toscana (Figura 4C). Nei Comuni con un basso grado di urbanizzazione l’incidenza è stata doppia rispetto ad aree con un grado medio-alto di urbanizzazione (9,6 casi/1.000.000 abitanti vs 4,9- 3,8 casi/1.000.000 abitanti).
Discussione e conclusioni
In Italia la trasmissione del TOSV è endemica e oltre 50 casi confermati di meningite, meningoencefalite ed encefalite sono stati notificati ogni anno da quando è stato istituito un sistema di sorveglianza nazionale.
L’andamento delle segnalazioni è caratterizzato da una forte stagionalità, con la maggior parte dei casi segnalati ogni anno tra i mesi di giugno e settembre, che coincide con il periodo di maggiore attività dei flebotomi (6).
Un numero particolarmente elevato di casi è stato osservato in Italia nel 2018, anno in cui l’incidenza ha raggiunto 1,5 casi/1.000.000 abitanti, quasi due volte quella osservata in media negli altri anni del periodo studiato. Questo aumento potrebbe essere messo in relazione con anomalie climatiche documentate lo stesso anno nell’emisfero settentrionale (29). In particolare, in Italia, sono state rilevate temperature più alte della norma nel mese di aprile (al Centro +3,74°C e al Nord +3,69°C) precedute e seguite, nei mesi di marzo e di maggio, da piogge abbondanti, estese a tutto il territorio nazionale (30). Questo potrebbe aver favorito una maggiore proliferazione e densità dei flebotomi (31) e una maggiore trasmissione di TOSV, analogamente a quanto osservato per le zanzare del genere Culex pipiens (32) nell’ambito dell’epidemia da virus West Nile, documentata nello stesso anno in Italia (33) e in altri Paesi europei (34-36).
L’incidenza più bassa di casi nel periodo di osservazione è stata riscontrata nel 2020, quando in risposta alla pandemia da COVID-19 sono state adottate in Italia le più stringenti di misure di sanità pubblica (lockdown). L’incidenza nel 2021 è stata invece simile a quanto osservato nel 2017.
La distribuzione geografica dei casi di infezione del SNC da TOSV non è uniforme sul territorio nazionale, con almeno un caso segnalato in nove Regioni italiane, prevalentemente centrosettentrionali, negli ultimi sei anni. L’osservazione che la maggior parte delle segnalazioni proviene dall’Emilia-Romagna non è necessariamente da ricondurre a una maggiore circolazione virale in questa Regione rispetto alle altre. Infatti, in Emilia- Romagna è attivo un protocollo di sorveglianza microbiologica che realizza, in tutti i casi di malattia neuro-invasiva che risulti negativa per virus West Nile e Usutu, un ulteriore accertamento diagnostico sistematico per TOSV. Nel 2012, questo approccio ha identificato l’infezione da TOSV come la più frequente eziologia in 120 casi di sospetta malattia neuro-invasiva identificati nel periodo estivo-autunnale (37). Questo suggerisce di interpretare la distribuzione geografica dei casi per Regione con cautela.
Stratificando per Regione/PA, tuttavia, l'incidenza di infezione del SNC da TOSV è risultata quasi doppia in Comuni con basso grado di urbanizzazione. Questo riscontro potrebbe essere legato a un maggiore rischio di esposizione in zone rurali e sarebbe coerente con le caratteristiche del vettore. Le larve di flebotomo sono terricole (non acquatiche come quelle delle zanzare) e si sviluppano tipicamente in ambienti ricchi di materiale organico in decomposizione (foglie secche, spoglie di altri insetti, feci di animali), a una temperatura relativamente costante e in una oscurità quasi completa. Questi ambienti sono più facilmente riscontrabili in contesti con basso grado di urbanizzazione (38).
La maggior parte dei casi di meningite, meningoencefalite ed encefalite da TOSV rilevati negli ultimi sei anni sono di sesso maschile e in età lavorativa. A differenza di quanto osservato nelle malattie neuroinvasive causate da altri arbovirus come il virus West Nile (39) o Chikungunya (40, 41), non si osserva un aumento dell’incidenza con l’aumentare dell’età. Questa osservazione suggerisce la necessità di ulteriori studi per identificare ulteriori fattori di rischio, specialmente professionali, non evidenziati da studi precedenti (42).
Negli ultimi due anni, in cui il dato sugli esiti è stato raccolto in modo sistematico, non sono stati riportati decessi, confermando come l’infezione, sebbene possa causare manifestazioni cliniche gravi, tenda a non causare la morte del paziente. In Italia ogni anno in media 49 ricoveri, concentrati nei mesi estivi, sono direttamente riconducibili a infezioni del SNC da TOSV.
La prevenzione delle infezioni da TOSV si realizza essenzialmente con misure comportamentali, in quanto individuare e intervenire sui focolai larvali è estremamente difficile, a differenza di quanto avviene per le zanzare. Inoltre, non sono disponibili farmaci specifici o vaccini efficaci.
Il nostro studio ha diversi limiti. Le infezioni da TOSV sono sottostimate in Paesi endemici in quanto sottodiagnosticate. Per questo i dati riportati nel presente lavoro e relativi solo a casi confermati di infezioni gravi del SNC non sono rappresentativi della reale diffusione dell’infezione e dello spettro di malattia nel nostro Paese. I dati raccolti dal sistema di sorveglianza sono soggetti a limiti di qualità e completezza che non hanno permesso di realizzare analisi più approfondite. La sottodiagnosi dell’infezione porta a una sottostima della reale incidenza riportata. Inoltre, non essendo i protocolli di accertamento diagnostico uniformi sul territorio nazionale, la sottodiagnosi potrebbe, a sua volta, non essere uniforme e influenzare la distribuzione osservata dei casi nelle diverse Regioni/PA. Infine, non è stato possibile realizzare un’analisi circa le sequele a breve e lungo termine che i casi descritti possono aver presentato e aver limitato l'analisi di esito alla notifica nella sorveglianza di decessi negli ultimi due anni potrebbe aver sostanzialmente sottostimato l’impatto complessivo di questa patologia sulla salute individuale.
Questo studio contribuisce ad acquisire maggiori conoscenze su TOSV, una arbovirosi endemica ma poco studiata. Una sorveglianza TOSV sempre più completa e tempestiva è uno strumento utile a favorire una migliore informazione e percezione del rischio e a incoraggiare l’adozione di misure di prevenzione comportamentale per evitare di essere esposti. L’analisi della distribuzione geografica dei casi di TOSV e dei fattori rischio della popolazione possono fornire elementi utili a indirizzare gli interventi sanità pubblica.
Ringraziamenti
Ringraziamo la dr.ssa Xanthi D. Andrianou (Cyprus University of Technology) per i suoi suggerimenti nella realizzazione dell'analisi e nella stesura del manoscritto.
Conflitti di interesse dichiarati: nessuno.
Authorship: tutti gli autori hanno contribuito in modo signifi cativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- King AMQ, Lefkowitz EJ, Mushegian AR, Adams M, Dutilh BE, Gorbalenya AE, et al. Changes to taxonomy and the International Code of Virus Classification and Nomenclature ratified by the International Committee on Taxonomy of Viruses (2018). Arch Virol 2018;163:2601-31. doi: 10.1007/ s00705-018-3847-1
- Ayhan N, Prudhomme J, Laroche L, Bañuls AL, Charrel RN. Broader Geographical Distribution of Toscana Virus in the Mediterranean Region Suggests the Existence of Larger Varieties of Sand Fly Vectors. Microorganisms 2020 Jan 14;8(1):114. doi: 10.3390/microorganisms8010114
- Dersch R, Sophocleous A, Cadar D, Emmerich P, Schmidt-Chanasit J, Rauer S. Toscana virus encephalitis in Southwest Germany: a retrospective study. BMC Neurol 2021 Dec 22;21(1):495. doi: 10.1186/s12883-021-02528-7
- Ayhan N, Charrel RN. An update on Toscana virus distribution, genetics, medical and diagnostic aspects. Clin Microbiol Infect 2020;26(8):1017-23. doi: 10.1016/j.cmi.2019.12.015
- Charrel RN, Bichaud L, de Lamballerie X. Emergence of Toscana virus in the mediterranean area. World J Virol 2012;1(5):135-41. doi: 10.5501/ wjv.v1.i5.135
- Bichaud L, Souris M, Mary C, Ninove L, Thirion L, Piarroux RP, et al. Epidemiologic relationship between Toscana virus infection and Leishmania infantum due to common exposure to Phlebotomus perniciosus sandfly vector. PLoS Negl Trop Dis 2011 Sep;5(9):e1328. doi: 10.1371/ journal.pntd.0001328
- Charrel RN, Gallian P, Navarro-Marí JM, Nicoletti L, Papa A, et al. Emergence of Toscana Virus in Europe. Emerg Infect Dis 11 (11):1657-63. doi: 10.3201/eid1111.050869
- Alkan C, Bichaud L, de Lamballerie X, Alten B, Gould EA, Charrel RN. Sandfly-borne phleboviruses of Eurasia and Africa: epidemiology, genetic diversity, geographic range, control measures. Antiviral Res 2013;100(1):54-74. doi: 10.1016/j. antiviral.2013.07.005
- Ayhan N, López-Roig M, Monastiri A, Charrel RN, Serra-Cobo J. Seroprevalence of Toscana Virus and Sandfly Fever Sicilian Virus in European Bat Colonies Measured Using a Neutralization Test. Viruses 2021;13(1):88. doi: 10.3390/v13010088
- Defilippo F, Carrera, M, Lelli D, Canziani S, Moreno A, Sozzi E, et al. Distribution of Phlebotomine Sand Flies (Diptera: Psychodidae) in the Lombardy Region, Northern Italy. Insects 2022;13(5):463. doi: 10.3390/insects13050463
- Busani L, Mughini Gras L, Romi R, Boccolini D, Severini F, Bongiorno G, et al. Zanzare, flebotomi e zecche: atlante bibliografico delle specie d’interesse sanitario in Italia (1985-2009). Roma: Istituto Superiore di Sanità; 2012. (Rapporti ISTISAN 12/22).
- Depaquit J, Grandadam M, Fouque F, Andry PE, Peyrefitte C. Arthropod-borne viruses transmitted by Phlebotomine sandflies in Europe: a review. Euro Surveill 2010;15(10):19507. PMID: 20403307.
- Verani P, Ciufolini MG, Nicoletti L, Balducci M, Sabatinelli G, Coluzzi M, et al. Studi ecologici ed epidemiologici del virus Toscana, un arbovirus isolato da flebotomi (Ecological and epidemiological studies of Toscana virus, an arbovirus isolated from Phlebotomus). Ann Ist Super Sanita 1982;18(3):397-9. PMID: 7187828.
- Calisher CH, Weinberg AN, Muth DJ, Lazuick JS. 1987. Toscana virus infection in United States citizen returning from Italy. Lancet 1987;1(8525):165-6. doi: 10.1016/s0140- 6736(87)92005-8
- Dobler G, Treib J, Haass A, Frösner G, Woesner R, Schimrigk K. Toscana virus infection in German travellers returning from the Mediterranean. Infection 1997;25(5):325. doi: 10.1007/BF01720413
- Veater J, Mehedi F, Cheung CK, Nabarro L, Osborne J, Wong N, et al. Toscana virus meningoencephalitis: an important differential diagnosis for elderly travellers returning from Mediterranean countries. BMC Geriatr 2017;17(1):193. doi. org/10.1186/s12877-017-0593-2
- Alwassouf S, Maia C, Ayhan N, Coimbra M, Cristovao JM, Richet H, et al. Neutralization-based seroprevalence of Toscana virus and sandfly fever Sicilian virus in dogs and cats from Portugal. J Gen Virol 2016;97(11):2816-23. doi: 10.1099/jgv.0.000592
- Dahmani M, Alwassouf S, Grech-Angelini S, Marié JL, Davoust B, Charrel RN. Seroprevalence of Toscana virus in dogs from Corsica, France. Parasit Vectors 2016;9(1):381. doi: 10.1186/s13071-016-1665-4
- Terrosi C, Olivieri R, Bianco C, Cellesi C, Cusi MG. Age-dependent seroprevalence of Toscana virus in central Italy and correlation with the clinical profile. Clin Vaccine Immunol 2009;16(8):1251-2. doi: 10.1128/CVI.00376-08
- Remoli ME, Fiorentini C, Marchi A, Di Renzi S, Vonesch N, Peri MV, et al. Seroprevalence survey of arboviruses in workers from Tuscany, Italy. Med Lav 2018;109(2):125-31. doi: 10.23749/mdl.v109i2.5024
- Fezaa O, Bahri O, Alaya Bouafif NB, Triki H, Bouattour A. Seroprevalence of Toscana virus infection in Tunisia. Int J Infect Dis 2013;17(12):e1172-5. doi: 10.1016/j.ijid.2013.08.008
- Alkan C, Allal-Ikhlef AB, Alwassouf S, Baklouti A, Piorkowski G, de Lamballerie X, et al. Virus isolation, genetic characterization and seroprevalence of Toscana virus in Algeria. Clin Microbiol Infect 2015;21(11):1040.e1-9. doi: 10.1016/j.cmi.2015.07.012
- Valassina M, Cusi MG, Valensin PE. A Mediterranean arbovirus: the Toscana virus. J Neurovirol 2003;9(6):577-83. doi: 10.1080/13550280390247678
- Ministero della Salute. Circolare n. 17200 del 16/06/2016 “Piano Nazionale di sorveglianza e risposta alle arbovirosi trasmesse da zanzare (Aedes sp.) con particolare riferimento a virus Chikungunya, Dengue e virus Zika - 2016”. www.trovanorme.salute.gov.it...; ultimo accesso: 21 giugno 2022.
- Istituto Superiore di Sanità. EpiCentro. Sistema nazionale di sorveglianza delle arbovirosi: i bollettini periodici. www.epicentro.iss.it/...; ultimo accesso: 21 giugno 2022.
- Ministero della Salute. Piano Nazionale di prevenzione, sorveglianza e risposta alle Arbovirosi (PNA) 2020-2025. www.salute.gov.it/...; ultimo accesso: 21 giugno 2022. 27.
- Istat.it - Censimento Popolazione Residente per età, sesso e stato civile al 1° gennaio (Internet). Available from: https://demo.istat.it/
- Istituto Nazionale di Statistica (Istat). 15° Censimento della popolazione e delle abitazioni 2011. www.istat.it/...; ultimo accesso: 21 giugno 2022.
- Vogel MM, Zscheischler J, Wartenburger R, Dee D, Seneviratne SI. Concurrent 2018 Hot Extremes Across Northern Hemisphere Due to Human-Induced Climate Change. Earths Future 2019;7(7):692- 703. doi:10.1029/2019EF001189
- Istituto Superiore per la Protezione e la Ricerca Ambientale. Gli indicatori del clima in Italia nel 2018. www.isprambiente.gov.it...; ultimo accesso: 21 giugno 2022.
- Alten B, Maia C, Afonso MO, Campino L, Jiménez M, González E, et al. Seasonal Dynamics of Phlebotomine Sand Fly Species Proven Vectors of Mediterranean Leishmaniasis Caused by Leishmania infantum. PLoS Negl Trop Dis 2016;10(2):e0004458. doi: 10.1371/journal.pntd.0004458
- Marini G, Calzolari M, Angelini P, Bellini R, Bellini S, Bolzoni L, et al. A quantitative comparison of West Nile virus incidence from 2013 to 2018 in Emilia-Romagna, Italy. PLoS Negl Trop Dis 2020;14(1):e0007953. doi: 10.1371/journal.pntd.0007953
- Riccardo F, Monaco F, Bella A, Savini G, Russo F, Cagarelli R, et al. An early start of West Nile virus seasonal transmission: the added value of One Heath surveillance in detecting early circulation and triggering timely response in Italy, June to July 2018. Euro Surveill 2018;23(32):1800427. doi:10.2807/1560-7917.ES.2018.23.32.1800427
- Haussig JM, Young JJ, Gossner CM, Mezei E, Bella A, Sirbu A, et al. Early start of the West Nile fever transmission season 2018 in Europe. Euro Surveill 2018;23(32):1800428. doi:10.2807/1560-7917. ES.2018.23.32.1800428
- Young JJ, Haussig JM, Aberle SW, Pervanidou D, Riccardo F, Sekulić N, et al. Epidemiology of human West Nile virus infections in the European Union and European Union enlargement countries, 2010 to 2018. Euro Surveil. 2021;26(19):2001095. doi: 10.2807/1560-7917.ES.2021.26.19.2001095. Erratum in: Euro Surveil. 2021 May;26(20): PMID: 33988124; PMCID: PMC8120798.
- Riccardo F, Bolici F, Fafangel M, Jovanovic V, Socan M, Klepac P, et al. West Nile virus in Europe: after action reviews of preparedness and response to the 2018 transmission season in Italy, Slovenia, Serbia and Greece. Global Health 2020;16(1):47. doi: 10.1186/s12992-020-00568-1. Erratum in: Global Health 2020 Jul 2;16(1):55. PMID: 32423479; PMCID: PMC7236470.
- Pierro A, Landini MP, Gaibani P, Rossini G, Vocale C, Finarelli AC, et al. A model of laboratory surveillance for neuro-arbovirosis applied during 2012 in the Emilia-Romagna region, Italy. Clin Microbiol Infect 2014;20(7):672-7. doi: 10.1111/1469- 0691.12436
- Feliciangeli MD. Natural breeding places of phlebotomine sandflies. Med Vet Entomol 2004;18(1):71- 80. doi: 10.1111/j.0269-283x.2004.0487.x. Erratum in: Med Vet Entomol. 2004 Dec;18(4):453. PMID: 15009450.
- McDonald E, Mathis S, Martin SW, Erin Staples J, Fischer M, Lindsey NP. Surveillance for West Nile virus disease - United States, 2009-2018. Am J Transplant 2021;21(5):1959-74. doi: 10.1111/ ajt.16595. PMID: 33939278.
- Rezza G, Nicoletti L, Angelini R, Romi R, Finarelli AC, Panning M, et al. Infection with chikungunya virus in Italy: an outbreak in a temperate region. Lancet 2007;370(9602):1840-6. doi: 10.1016/ S0140-6736(07)61779-6. PMID: 18061059.
- Riccardo F, Venturi G, Di Luca M, Del Manso M, Severini F, Andrianou X, et al. Secondary Autochthonous Outbreak of Chikungunya, Southern Italy, 2017. Emerg Infect Dis 2019;25(11):2093-5. doi: 10.3201/eid2511.180949. PMID: 31625839; PMCID: PMC6810187.
- Remoli ME, Fiorentini C, Marchi A, Di Renzi S, Vonesch N, Peri MV, et al. Seroprevalence survey of arboviruses in workers from Tuscany, Italy. Med Lav 2018;109(2):125-31. doi: 10.23749/mdl.v109i2.5024. PMID: 29701628; PMCID: PMC7682178.
(*) Componenti della Rete dei referenti regionali per le arbovirosi
Dalia Palmieri, Manuela Di Giacomo (Regione Abruzzo), Michele La Bianca (Regione Basilicata), Anna Domenica Mignuoli (Regione Calabria), Annunziata De Gaetano, Angelo D’Argenzio (Regione Campania), Claudio Gualanduzzi, Matteo Giulio, Giovanna Mattei (Regione Emilia Romagna), Micaela Castelli (Regione Friuli Venezia Giulia), Francesco Vairo (Regione Lazio), Camilla Sticchi, Roberto Moschi (Regione Liguria) , Danilo Cereda, Giulio Diurno, Lucia Crottogini (Regione Lombardia), Daniel Fiacchini, Fabio Filippetti (Regione Marche), Michele Colitti, Manuela Mariano (Regione Molise), Silvia Spertini (Provincia Autonoma di Bolzano), Maria Grazia Zuccali (Provincia Autonoma di Trento), Chiara Pasqualini, Daniela Lombardi (Regione Piemonte), Rosanna Prato (Regione Puglia), Maria Antonietta Palmas (Regione Sardegna), Mario Palermo (Regione Sicilia), Emanuela Balocchini, Francesco Angiò, Daniela Senatore (Regione Toscana), Anna Tosti (Regione Umbria), Mauro Ruffier (Regione Valle d’Aosta) Francesca Zanella (Regione Veneto).

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale