La relazione nel periodo pre Omicron e Omicron tra l’incidenza di COVID-19 e la percentuale di casi non associati a catene di trasmissione note in Friuli Venezia Giulia (settembre 2020-aprile 2022)
Anna Saramina, Yvonne Beorchiab, Alice Maria Del Collea, Silvia Gazzettaa, Luigi Castriottaa, b, c, Fabio Barbonea, b, c
aDipartimento di Area Medica, Università degli Studi di Udine
bIgiene ed Epidemiologia Clinica, Azienda Sanitaria Universitaria Friuli Centrale, Udine
cDirezione Centrale Salute Politiche Sociali e Disabilità, Regione Autonoma Friuli Venezia Giulia, Trieste
Citare come segue: Saramin A, Beorchia Y, Del Colle AM, Gazzetta S, Castriotta L, Barbone F. La relazione nel periodo pre Omicron e Omicron tra l’incidenza di COVID-19 e la percentuale di casi non associati a catene di trasmissione note in Friuli Venezia Giulia (settembre 2020-aprile 2022). Boll Epidemiol Naz 2022;3(3):10-9. DOI: https://doi.org/10.53225/BEN_049
Pre Omicron and Omicron relationship between COVID-19 incidence and the percentage of cases with unidentified chains of transmissions in Friuli Venezia Giulia, Italy (September 2020- April 2022)
Introduction
The study aimed to determine the relationship between COVID-19 incidence and contact tracing quality in Friuli Venezia Giulia Local Health Authorities (LHAs) AS1, AS2, AS3.
Materials and methods
Omicron regional prevalence divided the study period (21/09/2020-24/04/2022) into pre Omicron (21/09/2020- 26/12/2021) and Omicron (27/12/2021-24/04/2022). For each sub-period, regional and LHA-specific descriptive statistics on incidence and percentages of cases with unidentified chains of transmissions, household outbreaks and Contact Tracing (CT) quality index (complement of cases with unidentified chains of transmissions/managed cases multiplied by the complement of household outbreaks/active outbreaks, in percentage) were calculated. To investigate the relationship between CT quality index and incidence and between percentage of cases with unidentified chains of transmissions and incidence, regression analysis was performed.
Results
During Omicron, the regional weekly incidence exceeded 2,600cases/100k inhabitants (pre Omicron: 463 cases/100k inhabitants) and the maximum percentage of cases doubled with unidentified chains of transmissions (41% to 86%). Whilst the maximum regional percentage of household outbreaks was 90% in both sub-periods, the highest value of CT quality index was 53% in pre Omicron and 9% during Omicron. A clearly inverse relationship between incidence and CT quality index was found for AS2 and AS3 during pre Omicron and for AS1 and AS3 during Omicron.
Discussion and conclusions
During pre Omicron, differences emerged between LHAs in the relationship between incidence and the percentage of cases with unidentified transmission chains. Demographic and socio-cultural heterogeneity, as well as organisational differences between local health facilities, could explain these results. An inverse relationship is demonstrated between incidence and CT quality index.
Key words: contact tracing; COVID-19; disease outbreaks
Introduzione
Nel corso della pandemia da COVID-19, l’Italia ha introdotto misure di contenimento e mitigazione della diffusione dei casi di COVID-19 (1, 2), tra cui il contact tracing (CT) (3, 4). Quest’ultimo viene definito dall’Organizzazione Mondiale della Sanità come il processo di identificazione e gestione delle persone che possono essere state esposte a un caso di malattia durante il periodo di contagiosità del caso (5).
L’obiettivo del CT è interrompere precocemente la trasmissione della malattia da COVID-19 con la rapida identificazione e gestione dei contatti del caso primario (6). Storicamente è stato utilizzato anche per il controllo della diffusione di malattie infettive, come tubercolosi (7, 8), morbillo (8), sifilide e HIV (8-10). In Italia il CT, insieme alla sorveglianza epidemiologica e a quella attiva dei contatti, è un’attività di cui sono responsabili Regioni e Province Autonome, che ne affidano l’esecuzione ai Dipartimenti di Prevenzione delle aziende sanitarie (11). In Friuli Venezia Giulia (FVG) l’attività di CT viene effettuata dai Dipartimenti di Prevenzione delle tre Aziende Sanitarie (AS) afferenti ai territori delle ex province di Udine, Pordenone e Trieste- Gorizia. I casi COVID-19 vengono contattati con intervista telefonica dai Dipartimenti di Prevenzione che, oltre a raccogliere le informazioni cliniche rilevanti e a fornire istruzioni sui comportamenti da tenere, effettuano un’indagine epidemiologica per individuare fonte del contagio e possibili contatti (8, 11), cioè le persone esposte al caso COVID-19 dalle 48 ore antecedenti l’insorgenza dei sintomi o la positività del test diagnostico in caso di soggetti asintomatici (11). In base al tipo di esposizione, i contatti vengono classificati in contatti stretti (esposizione ad alto rischio) e contatti casuali (esposizione a basso rischio) (8, 11).
La presenza di due o più casi collegati epidemiologicamente tra loro identifica un focolaio (12) e il primo a essere individuato dall’autorità sanitaria viene definito caso indice (13). L’applicazione rigorosa e tempestiva del CT risulta difficile quando il numero di casi identificati aumenta in breve tempo (8, 14). In tale contesto, l'European Centre for Disease Prevention and Control (ECDC) suggerisce di indirizzare il tracciamento prioritariamente verso i casi che si verificano in ambienti ad alto rischio (strutture di assistenza a lungo termine, ospedali, prigioni e campi profughi) con l’obiettivo di limitare la trasmissione e l’impatto nelle popolazioni vulnerabili (14).
Con il Decreto Ministeriale (DM) del 30 aprile 2020, in linea con la metodologia della valutazione rapida del rischio dell’ECDC, è stato introdotto un sistema di sorveglianza basato su indicatori di processo e di risultato, con lo scopo di definire periodicamente il livello di rischio sanitario (15, 16). Tra gli indicatori di risultato relativi alla stabilità di trasmissione e alla tenuta dei servizi sanitari sono da includere il monitoraggio settimanale su base regionale di numero, estensione e setting dei diversi focolai attivi (Indicatore 3.5) e il numero di nuovi casi di infezione confermata da SARS-CoV-2 non associati a catene di trasmissione note (Indicatore 3.6) (12). Un aumento del numero di focolai indica una situazione epidemiologica in evoluzione, ma non è automaticamente espressione di un aumento della trasmissione, in quanto una maggiore identificazione anche di micro-focolai sul territorio può essere il risultato di una migliore attività di CT.
La presenza di nuovi casi non associati a catene di trasmissione note può indicare, alternativamente, uno scenario di bassa circolazione virale nel caso dell’assenza di focolai di trasmissione attivi oppure una criticità del CT, qualora si associ a incidenza elevata e/o all’esistenza o all’aumento dei focolai (12).
Tuttavia, nell’interpretazione dei dati relativi ai focolai bisogna tener presente che un’alta percentuale di focolai familiari, tra i focolai attivi individuati, può essere espressione di un’elevata trasmissione in tale contesto, ma va altresì considerato che nel setting familiare risulta più semplice l’individuazione del caso indice introducendo quindi un bias di informazione nella stima del rischio associato ai diversi setting (17).
Un altro fattore da considerare è l’eterogeneità demografica, abitativa e socio-culturale delle AS. Ad esempio, il territorio della ex provincia di Trieste ha una densità abitativa circa dieci volte superiore a quella della ex provincia di Udine (18). Ipotizzando che l’aumento dell’incidenza abbia un impatto sull’attività di CT in termini di aumento del numero di casi non associati a catene di trasmissione note e di aumento della frazione di focolai familiari tra quelli attivi, questo studio si propone di indagare e caratterizzare la relazione tra l’incidenza di infezioni da SARS-CoV-2 e la qualità del CT sia a livello regionale che per singola AS, tenendo conto delle eterogeneità tra i territori.
Materiali e metodi
Lo studio è di tipo descrittivo, realizzato su dati relativi ai focolai e al numero di casi non associati a catene di trasmissione note, raccolti in forma aggregata e su base settimanale dai Dipartimenti di Prevenzione delle rispettive AS nell’ambito del monitoraggio nazionale effettuato dall’Istituto Superiore di Sanità (ISS), che prevede il calcolo settimanale degli Indicatori 3.5 e 3.6 (12,16).
Il periodo di studio è compreso tra il 21 settembre 2020 e il 24 aprile 2022, per un totale di 83 settimane di osservazione. I casi confermati sono definiti tali sulla base della normativa nazionale e regionale (1, 2, 19, 20).
L’incidenza è stata calcolata moltiplicando per 100.000 il rapporto tra nuovi casi positivi su base settimanale e la popolazione al 1° gennaio dell’anno di riferimento, rilevata dai dati censuari pubblicati dall’Istat. I dati relativi ai nuovi casi positivi sono stati estratti dalla banca dati del sistema informativo sanitario regionale del FVG.
La percentuale di casi non associati a catene di trasmissione note viene calcolata su base settimanale come rapporto tra i nuovi casi positivi non associati a catene di trasmissione note sul totale dei casi positivi presi in carico dal Dipartimento di Prevenzione, cioè quelli per cui è stata eseguita l’indagine epidemiologica. La percentuale di focolai familiari sui focolai di trasmissione attivi (12) indica la quota di focolai familiari tra quelli attivi individuati dal CT. Assumendo che la qualità del CT sia funzione della capacità di associazione di un caso positivo a una catena di trasmissione nota (12), ovvero a un caso indice, e ipotizzando una maggiore facilità nell’individuazione del caso indice in un focolaio familiare (17), è stato definito l’indicatore di qualità del CT, che tiene conto di entrambi gli aspetti.

L'indicatore è espresso in termini percentuali e viene calcolato moltiplicando il complementare della proporzione di casi non associati a catene di trasmissione note per il complementare della proporzione di focolai familiari sui focolai di trasmissione attivi. Per l’incidenza settimanale, l’indicatore della qualità del CT e le percentuali di casi non associati a catene di trasmissione note e di focolai familiari sui focolai di trasmissione attivi, sono state calcolate le seguenti statistiche sia per la Regione nel suo complesso che per AS: minimo, massimo, mediana, range interquartile, media e deviazione standard.
Le analisi sono state condotte in due sottoperiodi, suddivisi sulla base della diffusione in Regione della variante Omicron: un sottoperiodo pre Omicron (21 settembre 2020-26 dicembre 2021; 66 settimane di osservazione) e uno Omicron (27 dicembre 2021-24 aprile 2022; 17 settimane di osservazione). Questa suddivisione è stata effettuata considerando che, a partire dalla 51a settimana, la variante Omicron (B.1.1.529-like+BA.1-like) ha prevalso sulle altre varianti (78% dei 27 sequenziamenti effettuati, dati da flash survey condotte in FVG e coordinate dall’ISS). La relazione dell’incidenza con la percentuale di casi non associati a catene di trasmissione note e con l’indicatore della qualità del CT è stata indagata mediante grafici di dispersione e analisi di regressione lineare univariata. Nel caso in cui i grafici di dispersione suggeriscano un andamento non lineare dei dati, oltre al modello di regressione lineare semplice, sono stati stimati anche modelli di regressione differenti. L’analisi è stata effettuata per entrambi i sottoperiodi sia a livello regionale che stratificando per AS. Le assunzioni di normalità e omoschedasticità dei residui alla base del modello lineare sono state verificate rispettivamente con il test di Shapiro-Wilk (21, 22) e di Breusch-Pagan e Cook-Weisberg (23, 24). La bontà di adattamento è stata valutata mediante il coefficiente di determinazione corretto (R2 corretto) (22). Il livello di significatività considerato è pari a a = 0,05. Per la gestione dei dati è stato utilizzato il software SAS Enterprise Guide Version 7.15 HF9. Le analisi sono state eseguite utilizzando i software RStudio Version 1.3.1093 e Stata Statistical Software: Release 17. College Station, TX: StataCorp LLC.
Risultati
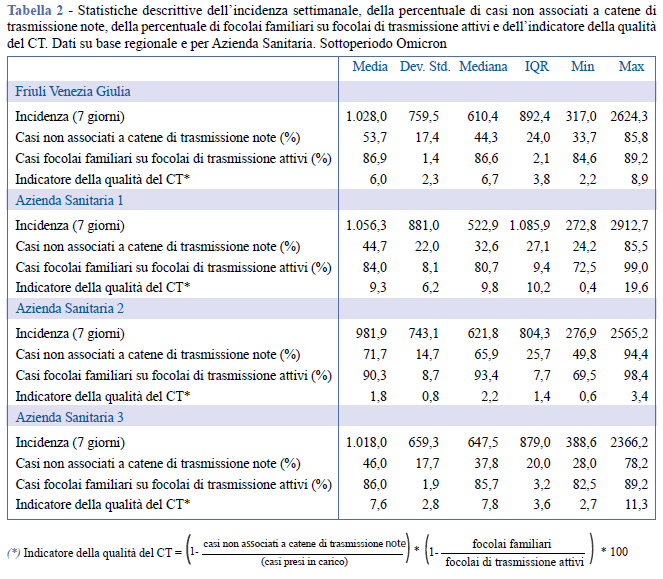
Nella Tabella 1 sono riportate le statistiche descrittive dell’incidenza settimanale, delle percentuali di casi non associati a catene di trasmissione note, di focolai di trasmissione familiari sul totale dei focolai di trasmissione attivi e dell’indicatore della qualità del CT, con dati relativi al pre Omicron, sia su base regionale che per ciascuna AS. Nella Tabella 2 sono riportate le stesse statistiche riferite al sottoperiodo Omicron. In Figura 1 vengono riportati per entrambi i sottoperiodi i grafici di dispersione per la percentuale di casi non associati a catene di trasmissione note. In Figura 2 vengono riportati gli stessi grafici per l’indicatore della qualità del CT.
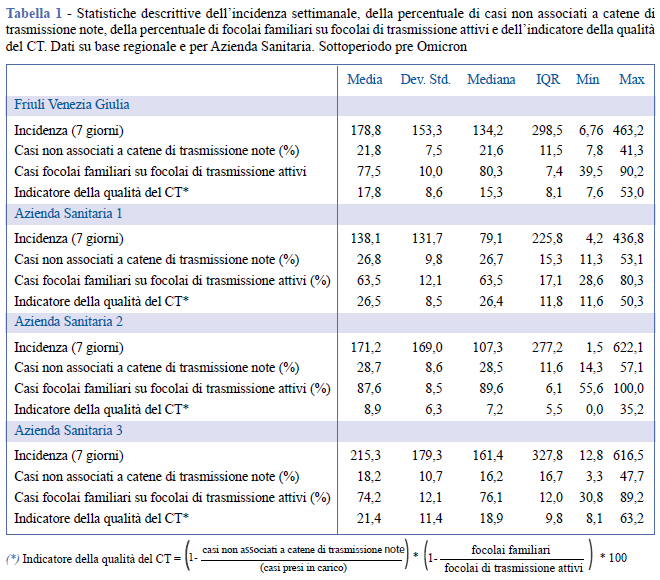
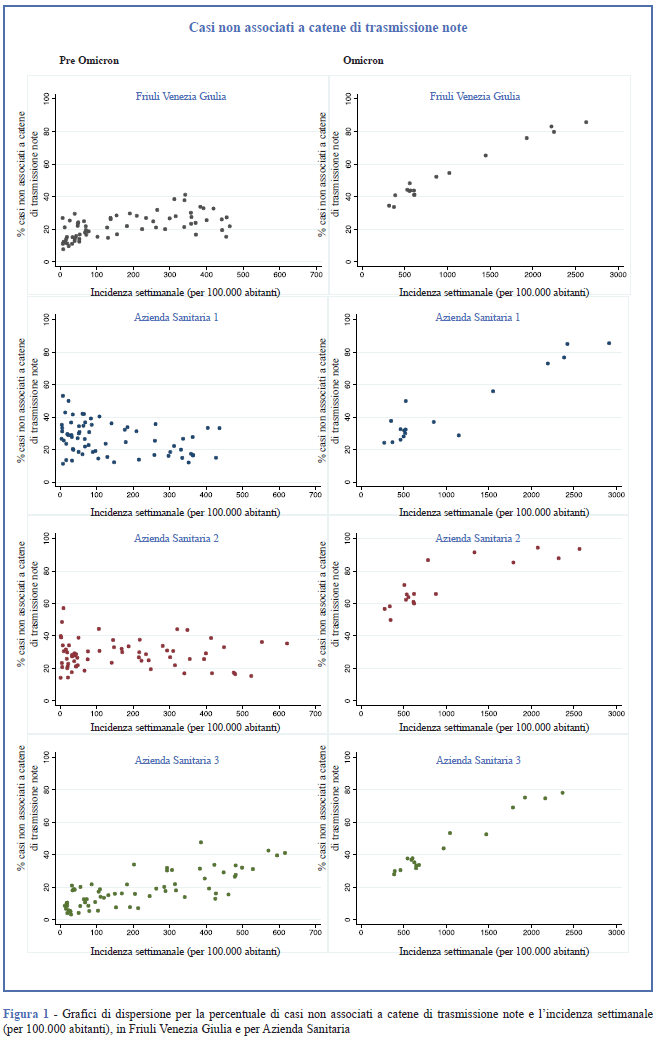
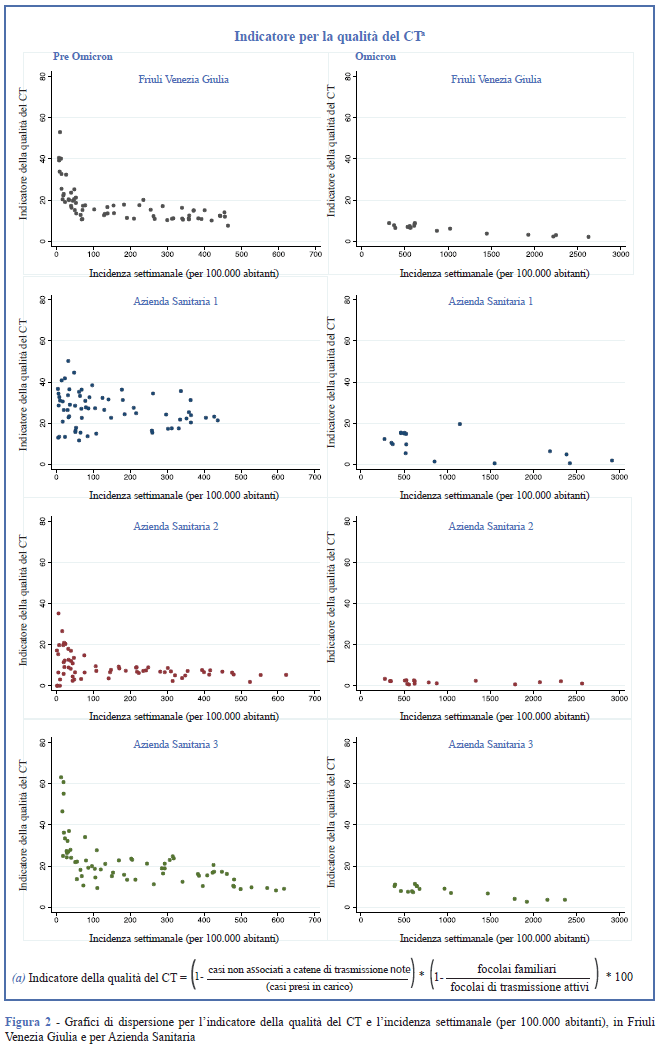
Nel sottoperiodo pre Omicron, in Regione l’incidenza settimanale ha assunto valori compresi tra 7 e 463 casi ogni 100.000 abitanti. In questo contesto, la percentuale di casi non associati a catene di trasmissione note ha raggiunto il 41,3% (Figura 1) e su 10 focolai attivi individuati, almeno 4 erano di tipo familiare (39,5%). All’aumentare dell’incidenza, l’indicatore della qualità del CT ha assunto valori sempre più bassi fino a raggiungere il valore minimo di 7,6% (Figura 2). Inoltre, dal grafico di dispersione si apprezza una diminuzione più sostenuta per valori di incidenza inferiori a 100 casi per 100.000 abitanti (Figura 2). Dai risultati per AS si osserva che mentre per l’AS2 e l’AS3 l’incidenza ha superato i 600 casi ogni 100.000 abitanti, in AS1 ha raggiunto il picco massimo di 437 casi ogni 100.000 abitanti. I grafici di dispersione sembrano suggerire l’esistenza di un’associazione diretta dell’incidenza con la percentuale di casi non associati a catene di trasmissione note per l’AS3, e inversa per l’AS1 (Figura 1). Tra le AS, la percentuale di focolai familiari su quelli attivi è stata mediamente più alta in AS2. Per tutte le AS si è osservato che l’indicatore della qualità del CT ha assunto valori più alti in corrispondenza di valori di incidenza più bassi (Figura 2).
Durante il sottoperiodo Omicron, l’incidenza settimanale su base regionale ha superato i 2.600 casi ogni 100.000 abitanti e non è mai stata inferiore a 317 casi ogni 100.000 abitanti. Dal grafico di dispersione riportato in Figura 1 si osserva in corrispondenza dell’aumento dell’incidenza un aumento della percentuale di casi non associati a catene di trasmissione note che ha raggiunto l’85,8%. In questo contesto, tra i focolai attivi, almeno l’84,6% era di tipo familiare, e l’indicatore della qualità del CT non ha mai assunto valori superiori all’8,9%. Dai risultati per AS si osserva che la percentuale di casi non associati a catene di trasmissione note ha raggiunto valori prossimi all’80% in AS3, superiori all'85% in AS1 e AS2, con valori che aumentano all’aumentare dell’incidenza (Figura 1). Per tutte le AS almeno il 70% dei focolai individuati era di tipo familiare. L’indicatore della qualità del CT ha assunto valori inferiori al 20% nelle tre AS.
In Tabella 3 vengono presentati i risultati dell’analisi di regressione lineare e semplice tra percentuale di casi non associati a catene di trasmissione note (variabile dipendente) e incidenza (variabile indipendente).
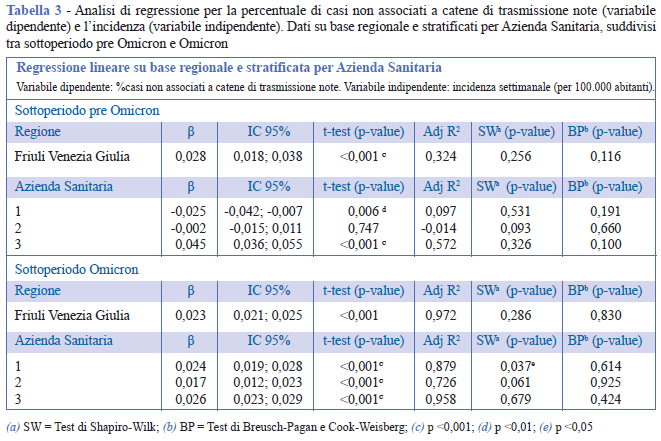
Nel Materiale Aggiuntivo sono riportati i risultati delle analisi di regressione effettuate anche con modelli diversi da quello lineare semplice (Materiale Aggiuntivo - Tabella 1) ed i grafici delle curve stimate (Materiale Aggiuntivo - Figura 1). A livello regionale, l’incidenza è direttamente associata alla percentuale di casi non associati a catene di trasmissione note in entrambi i sottoperiodi.
Dai risultati dell’analisi stratificata per AS, nel pre Omicron l’associazione tra incidenza e percentuale di casi non associati a catene di trasmissione note è inversa per l’AS1 (β=-0,025; IC 95%: -0,042;-0,007), assente per l’AS2 (β =-0,002; IC 95%:-0,015;-0,011), diretta per l’AS3 (β = 0,045; IC 95%: 0,036;0,055). Durante il sottoperiodo Omicron l’associazione è diretta per tutte le AS. Nel sottoperiodo Omicron i valori di R2 corretto sono superiori al 70% per tutti i modelli, mentre nel sottoperiodo pre Omicron l’incidenza spiega una minore quota di variabilità della percentuale di casi non associati a catene di trasmissione note. Tuttavia, l’ipotesi di distribuzione normale dei residui non è verificata per il modello stimato per l’AS1 durante il sottoperiodo Omicron.
I risultati dei modelli stimati per indagare la relazione tra l’indicatore della qualità del CT (variabile dipendente) e l’incidenza (variabile indipendente) vengono presentati in Tabella 4. I risultati delle analisi di regressione con modelli anche diversi rispetto a quello lineare semplice sono riportati nel Materiale Aggiuntivo - Tabella 2 e i grafici delle curve stimate nel Materiale Aggiuntivo - Figura 2.
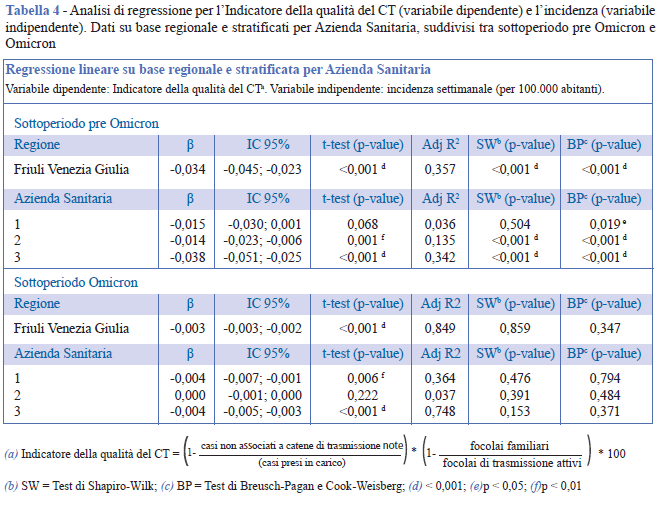
A livello regionale, l’incidenza è associata inversamente con l’indicatore della qualità del CT in entrambi i sottoperiodi. Nel sottoperiodo pre Omicron, anche dall’analisi stratificata emerge per tutte e tre le AS la presenza di un’associazione inversa tra l’incidenza e l’indicatore della qualità del CT. Tuttavia, per l’AS1 l’associazione non raggiunge la significatività statistica. Durante il sottoperiodo Omicron, in AS2 l’indicatore della qualità del CT non sembra variare all’aumentare dell’incidenza, mentre per l’AS1 e l’AS3 si osserva un’associazione inversa tra variabili: per entrambi i modelli stimati, l’aumento settimanale di 100 casi (per 100.000 abitanti) è associato a una diminuzione in media pari allo 0,4% del valore dell’indicatore della qualità del CT. In considerazione della verifica degli assunti di base del modello, il modello lineare sembra essere adatto a spiegare la relazione tra incidenza e indicatore della qualità del CT solo per il sottoperiodo Omicron.
Discussione e conclusioni
L’arrivo della variant of concern Omicron nella Regione ha avuto un impatto considerevole sull'incidenza dei contagi da SARS-CoV-2; il fenomeno si pone in linea con quanto osservato a livello nazionale e internazionale (25, 26).
I motivi dell’aumento dei contagi sono attribuibili all’interazione di diversi fattori. Innanzitutto, Omicron è caratterizzata da una infettività superiore di almeno dieci volte rispetto al virus originario e da una maggiore quota di infezioni asintomatiche, che hanno facilitato la trasmissione del contagio (27, 28). Inoltre, Omicron è arrivata nel contesto di un sistema sanitario già messo a dura prova da un periodo di crisi senza precedenti per intensità e durata.
L’aumento di quasi sei volte dell’incidenza media regionale rilevato successivamente alla diffusione di Omicron è stato accompagnato dall’incremento cospicuo in tutto il FVG della percentuale di casi non riconducibili a catene di trasmissione note su casi presi in carico, fatto che spinge ad avanzare due ipotesi principali che peraltro non si escludono vicendevolmente. In primo luogo, l’aumento di questa proporzione potrebbe scaturire dalla difficoltà di ricondurre i contagi a contatti noti a causa della maggiore trasmissibilità della variante Omicron (28). In secondo luogo, le cause potrebbero altresì risiedere nel superamento della capacità di tracciamento. Infatti, il sistema di CT manuale ha un limite intrinseco legato alla sua gravosità in termini di tempi e risorse umane richieste (29-32). Lo stress del sistema potrebbe avere influito negativamente sulla completezza delle informazioni raccolte durante le interviste, contribuendo a giustificare l’aumento dei casi non associati a catene di trasmissione note.
Dai modelli stimati tra percentuale di casi non associati a catene di trasmissione note e incidenza nel sottoperiodo pre Omicron sono emerse differenze tra le AS della Regione (Tabella 3). Queste diversità potrebbero essere ricondotte all’eterogeneità demografica, abitativa e socioculturale delle popolazioni di riferimento (18).
In merito all’età anagrafica, la ex provincia di Pordenone ha la struttura demografica più giovane con un indice di vecchiaia di 184, mentre nell’ex provincia di Trieste la popolazione è mediamente più vecchia e presenta l’indice di vecchiaia più alto, pari a 265. Le altre due ex province, invece, presentano valori di tale indice superiori a 230 (18).
La letteratura suggerisce l’esistenza di diverse dinamiche di interazione sociale all’interno delle fasce di età (33, 34). Inoltre, il CT dei soggetti più anziani, soprattutto se istituzionalizzati, potrebbe essere meno efficace a causa di deficit cognitivi che potrebbero limitare l’accuratezza delle informazioni raccolte durante le interviste telefoniche (35).
A tal proposito, in FVG, fin dalle prime fasi della pandemia, i Dipartimenti di Prevenzione hanno istituito appositi gruppi di lavoro dedicati al CT delle residenze per anziani. Tuttavia, non sono disponibili misure relative all’eventuale miglioramento della qualità del CT attribuibile all’attività specifica di questi gruppi di lavoro.
Un’altra possibile spiegazione delle differenze osservate tra le AS locali potrebbe risiedere in eventuali differenze organizzative che andrebbero indagate in modo specifico. A questo proposito è necessario ricordare che, fatto salvo quanto stabilito dal DM del 30 aprile 2020 relativamente alle risorse per CT, isolamento e quarantena, le disposizioni regionali specifiche in materia hanno consentito l’autonomia di risposta delle singole AS in considerazione delle peculiarità dei territori afferenti. La tipologia delle analisi effettuate è stata limitata dal tipo di dati a disposizione che, nello specifico, per quanto riguarda i focolai, erano aggregati su base settimanale. I casi non associati a catene di trasmissione note sono casi incidenti, relativi alla settimana di riferimento, mentre per la medesima settimana, i casi associati a focolaio sono sia casi incidenti che prevalenti. I dati di incidenza non sono standardizzati né per età né per sesso, rendendo più difficoltosa la loro interpretazione. La percentuale di casi non associati a catene di trasmissione note e l’indicatore della qualità del CT sono stati utilizzati come misura di valutazione del tracciamento. Tuttavia, nell’ambito dell’interruzione delle catene di trasmissione, l’individuazione del caso indice è solo uno degli elementi che determinano la qualità del CT. La tempestività della presa in carico del caso risulta anch’essa fondamentale a questo scopo (36).
In conclusione, dalle analisi effettuate è emerso che, nella fase pre Omicron, la relazione tra incidenza e percentuale di casi non associati a catene di trasmissione note sembra essere eterogenea tra le AS, mentre durante Omicron l'associazione diretta tra variabili riguarda tutte le AS. Durante entrambi i sottoperiodi l’associazione tra l’indicatore della qualità del CT e l’incidenza è inversa, sia a livello regionale che per AS, eccetto che per l’AS2 durante il periodo Omicron. Il presente studio indaga una relazione attualmente ancora poco esplorata nella letteratura scientifica.
L’analisi ha messo in evidenza la presenza di variabilità interaziendali che forniscono uno spunto per successivi approfondimenti utili all’individuazione dei determinanti di tale eterogeneità e alla valutazione dell’efficacia dei diversi modelli organizzativi. Un altro punto di forza è la durata del periodo di osservazione, che comprende la seconda, la terza e la quarta ondata pandemica.
Lo studio, inoltre, fornisce evidenza delle difficoltà di CT durante la fase Omicron della pandemia, spingendo a riflessioni circa la sostenibilità delle attuali modalità di tracciamento e l’appropriatezza dei riferimenti forniti in termini di risorse da dedicare alle attività di CT, isolamento e quarantena, calcolate non sulla base dell’incidenza, ma della popolazione residente.
Conflitti di interesse dichiarati: nessuno.
Finanziamenti: nessuno.
Authorship: tutti gli autori hanno contribuito in modo signifi cativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- Italia. Ministero della Salute. Aggiornamento della definizione di caso COVID-19 e strategie di testing. Circolare n. 705, 8 gennaio 2021.
- Italia. Ministero della Salute. COVID-19. Aggiornamento della definizione di caso. Circolare n. 7922, 9 marzo 2020.
- Italia. Presidenza del Consiglio dei Ministri. Coronavirus, le misure adottate dal Governo. www.governo.it/it/...; ultimo accesso 8/11/2022.
- 4. Italia. Presidenza del Consiglio dei Ministri. Coronavirus, la normativa vigente. www.governo.it/... ; ultimo accesso 8/11/2022.
- WHO. Coronavirus disease (COVID-19): Contact tracing. 31/5/2021. https://www.who.int/...; ultimo accesso 8/11/2022.
- European Centre for Disease Prevention and Control. Contact tracing: public health management of persons, including healthcare workers, having had contact with COVID-19 cases in the European Union - second update, 31 March 2020. Stockholm: ECDC; 2020.
- Fox GJ, Barry SE, Britton WJ, Marks GB. Contact investigation for tuberculosis: a systematic review and meta-analysis. Eur Respir J 2013;41(1):140-56. doi: 10.1183/09031936.00070812
- Filia A, Urdiales AM, Rota MC. Guida per la ricerca e gestione dei contatti (contact tracing) dei casi di COVID-19. Versione del 25 giugno 2020. Roma: Istituto Superiore di Sanità; 2020. (Rapporto ISS COVID-19, n. 53/2020).
- Rutherford GW, Woo JM. Contact tracing and the control of human immunodeficiency virus infection. JAMA 1988;259(24):3609-10. PMID: 3131557.
- Reddel S, Edmiston N. Contact tracing for STIs - new resources and supportive evidence. Aust Fam Physician 2012;41(3):128-32. PMID: 22396926
- Ministero della Salute. Ricerca e gestione dei contatti di casi COVID-19 (Contact tracing) ed App Immuni. Circolare n. 18584, 29 maggio 2020.
- Ministero della Salute. Istituto Superiore di Sanità. Sistema Indicatori di cui al DM 30 aprile 2020 - Documento metodologico. Versione 1.0, 19 maggio 2020.
- Giesecke J. Primary and index cases. Lancet 2014;384(9959):2024. doi: 10.1016/S0140- 6736(14)62331-X.
- European Centre for Disease Prevention and Control. Contact tracing in the European Union: public health management of persons, including healthcare workers, who have had contact with COVID-19 cases – fourth update, 28 October 2021. Stockholm: ECDC; 2021.
- European Centre for Disease Prevention and Control. Operational tool on rapid risk assessment methodology - ECDC 2019. Stockholm: ECDC; 2019.
- Italia. Ministero della Salute. Decreto del 30 aprile 2020. Adozione dei criteri relativi alle attività di monitoraggio del rischio sanitario di cui all’allegato 10 del decreto del Presidente del Consiglio dei ministri del 26 aprile 2020. (20A02444) Gazzetta Ufficiale - Serie Generale n. 112, 2 maggio 2020.
- Sanguinetti G. Perché i dati di tracciamento vanno presi con le pinze. Scienza in rete. 26/10/2022. www.scienzainrete.it/...; ultimo accesso 8/11/2022.
- Istituto Nazionale di Statistica. Il Censimento permanente della popolazione in Friuli Venezia Giulia. 23 marzo 2022. www.istat.it/...; ultimo accesso 8/11/2022.
- Regione Autonoma Friuli Venezia Giulia. Emergenza COVID-19. Effettuazione di test diagnostici per SARS- COV-2. Prot. n. 35247/P del 31/12/2021.
- Italia. Ministero della Salute. Flusso dati aggregati Ministero della Salute/Protezione Civile: aggiornamento sulla possibilità di inserimento delle reinfezioni da SARS-CoV-2. Circolare n. 37911, 23 agosto 2021. www.seremi.it/...; ultimo accesso 2/11/2022.
- Shapiro SS, Wilk MB. An analysis of variance test for normality (complete samples). Biometrika 1965;52(3-4):591-611.
- Grigoletto M, Pauli F, Ventura L. Modello lineare: teoria e applicazioni con R. Torino: G. Giappichelli Editore; 2017.
- Breusch TS, Pagan AR. A Simple Test for Heteroscedasticity and Random Coefficient Variation. Econometrica 1979;47(5):1287-94. doi. org/10.2307/1911963
- Cook RD, Weisberg S. Diagnostics for heteroscedasticity in regression. Biometrika 1983;70(1):1-10. doi.org/10.1093/biomet/70.1.1
- Khandia R, Singhal S, Alqahtani T, Kamal MA, El- Shall NA, Nainu F, et al. Emergence of SARS-CoV-2 Omicron (B.1.1.529) variant, salient features, high global health concerns and strategies to counter it amid ongoing COVID-19 pandemic. Environ Res 2022;209:112816. doi: 10.1016/j.envres.2022.112816
- Koelle K, Martin MA, Antia R, Lopman B, Dean NE. The changing epidemiology of SARS-CoV-2. Science 2022;375(6585):1116-21. doi: 10.1126/ science.abm4915
- Accorsi EK, Britton A, Fleming-Dutra KE, Smith ZR, Shang N, Derado G, et al. Association Between 3 Doses of mRNA COVID-19 Vaccine and Symptomatic Infection Caused by the SARS-CoV-2 Omicron and Delta Variants. JAMA 2022;327(7):639-51. doi: 10.1001/jama.2022.0470
- Ren SY, Wang WB, Gao RD, Zhou AM. Omicron variant (B.1.1.529) of SARS-CoV-2: Mutation, infectivity, transmission, and vaccine resistance. World J Clin Cases 2022;10(1):1-11. doi: 10.12998/wjcc.v10.i1.1
- Tupper P, Otto SP, Colijn C. Fundamental limitations of contact tracing for COVID-19. FACETS 2021;6:1993-2001. doi: 10.1139/facets-2021-0016
- Hellewell J, Abbott S, Gimma A, Bosse NI, Jarvis CI, Russell TW, et al. Feasibility of controlling COVID-19 outbreaks by isolation of cases and contacts. Lancet Glob Health 2020;8(4):e488-96. doi: 10.1016/S2214-109X(20)30074-7
- World Health Organization. Contact tracing in the context of COVID-19: interim guidance, 1 February 2021. apps.who.int/...; ultimo accesso 8/11/2022.
- European Centre for Disease Prevention and Control. Contact tracing for COVID-19: current evidence, options for scale-up and an assessment of resources needed. Stockholm: ECDC; 2020.
- Moon SA, Scoglio CM. Contact tracing evaluation for COVID-19 transmission in the different movement levels of a rural college town in the USA. Sci Rep 2021;11(1):4891. doi.org/10.1038/ s41598-021-83722-y
- Moreno López JA, Arregui García B, Bentkowski P, Bioglio L, Pinotti F, Boëlle PY, et al. Anatomy of digital contact tracing: Role of age, transmission setting, adoption, and case detection. Sci Adv 2021;7(15):eabd8750. doi: 10.1126/sciadv.abd8750
- Wilmink G, Summer I, Marsyla D, Sukhu S, Grote J, Zobel G, et al. Real-Time Digital Contact Tracing: Development of a System to Control COVID-19 Outbreaks in Nursing Homes and Long-Term Care Facilities. JMIR Public Health Surveill 2020;6(3):e20828. doi: 10.2196/20828
- Kretzschmar ME, Rozhnova G, Bootsma MCJ, van Boven M, van de Wijgert JHHM, Bonten MJM. Impact of delays on effectiveness of contact tracing strategies for COVID-19: a modelling study. Lancet Public Health 2020;5(8):e4529. doi: 10.1016/S2468-2667(20)30157-2

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale