Da Comitato Etico dell’Istituto Superiore di Sanità a Comitato etico nazionale per le sperimentazioni degli enti pubblici di ricerca e altri enti pubblici a carattere nazionale: la ricerca valutata negli anni 2021-2023
Sabina Gainottia*, Cristina Morcianob*, Giovanna Floridiaa, Luciana Rivaa, Flavia Mayerb, Susanna Tamiozzoa, Carlo D'Aprilea, Elisabetta Amoria, Carlo Petrinia
(*) Stesso contributo
aUnità di Bioetica, Istituto Superiore di Sanità, Roma
b Centro Nazionale per la Ricerca e la Valutazione Preclinica e Clinica dei Farmaci, Istituto Superiore di Sanità, Roma
Citare come segue: Gainotti S, Morciano C, Floridia G, Riva L, Mayer F, Tamiozzo S, D'Aprile C, Amori E, Petrini C. Da Comitato Etico dell’Istituto Superiore di Sanità a Comitato etico nazionale per le sperimentazioni degli enti pubblici di ricerca e altri enti pubblici a carattere nazionale: la ricerca valutata negli anni 2021-2023. Boll Epidemiol Naz 2024;5(3):1-9. DOI: https://doi.org/10.53225/BEN_091
From Research Ethics Committee of the Istituto Superiore di Sanità to National Ethics Committee for clinical trials of public research bodies (EPR) and other national public institutions (CEN): evaluation of research activity during the years 2021-2023
Introduction
The Ethics Committee of the Istituto Superiore di Sanità (CE ISS) was established in 1999 by decree of the Ministry of Health. Since then, the CE ISS has been evaluating different types of studies carried out with the coordination or the participation of the ISS. On 2022, the National ethics committee for clinical trials of public research bodies and other national public institutions was established at the ISS (CEN EPR), replacing the role of the CE ISS and broadening its scope to the evaluation of studies coming from different public research bodies.
Materials and methods
The present work describes census data of research studies evaluated by the CE ISS and CEN EPR in the years from 2021 to 2023 and describes characteristics of the studies evaluated according to a set of prespecified information abstracted from the study protocols and summary templates.
Results
In the study period, a total of 220 evaluation requests were examined, 142 of which were evaluation of new studies (64.4%). Most of the studies were coordinated by the ISS, had a national coverage and were financed through public fundings. Studies were mainly observational (66.2%), while a minor proportion was represented by in vitro studies, (12.7%) interventional (8.5%), registries creation (4.9%), qualitative (4.2%) and mixed methods studies (3.5%). The type of studies evaluated by CE ISS and CEN EPR were in proportion comparable. However, in the CEN EPR there was an increased percentage of in vitro (from 8.3% to 14.9%) and interventional studies (from 6.3% to 9.6%). The most explored health/disease category of research was “infectious diseases” (25.4%) followed by “non-specific health categories”. Amongst the scopes of research activity, aetiology was the most common (44.4%). “Non-specific health categories” was the most funded area of research followed by “infectious diseases”.
Conclusions
The CE ISS and the CEN EPR kept their volume of activity relatively stable over the years examined with a slight increase during the CEN EPR in requests for evaluation of in vitro and interventional studies, particularly with medical devices, also coming from research bodies other than ISS and with fundings from private agencies and foundations. The members and secretariat of the CEN EPR must deal with these new requests with the specificities that the research protocols entail, from a methodological and regulatory point of view.
Key words: research ethics committee; research ethics; health research system
Introduzione
I comitati etici (CE) per la ricerca si occupano della revisione etica e scientifica di protocolli di studi condotti con il coinvolgimento di esseri umani, applicando principi di etica condivisi (1).
Secondo il Regolamento UE 2014/536 sulla sperimentazione clinica di medicinali per uso umano, un comitato etico è “un organismo indipendente istituito in uno Stato membro (…) incaricato di fornire pareri ai fini del presente regolamento che tenga conto della prospettiva dei non addetti ai lavori, in particolare i pazienti o le loro organizzazioni” (2).
In Italia, la rete di CE oggi attiva è il risultato di un processo storico iniziato più di 30 anni fa. Il CE dell’Istituto Superiore di Sanità (CE ISS) è stato istituito il 24 febbraio 1999 a seguito del Decreto ministeriale 18 marzo 1998: “Linee guida per l’istituzione e il funzionamento dei comitati etici” (3), ed è stato in vigore fino al 21 marzo 2022.
A partire dalla sua istituzione, il CE ISS ha avuto competenza in merito alla sperimentazione clinica di medicinali ma anche a molte altre attività, svolte sia in via esclusiva dall’ISS sia da altri enti in collaborazione con l’ISS, tra cui: progetti epidemiologici, valutativi e medico sociali che richiedono la raccolta di dati personali o campioni biologici, sistemi di sorveglianza, creazione di registri, survey, interventi di sanità pubblica, progetti con implicazioni di etica ambientale.
L’attuale assetto dei CE in Italia si è delineato con la Legge 11 gennaio 2018, n. 3 “Delega al Governo in materia di sperimentazione clinica dei medicinali e disposizioni per il riordino delle professioni sanitarie e per la direzione sanitaria del Ministero della Salute” (4), che ha stabilito il limite di 40 CE cosiddetti territoriali (CET) e l’istituzione di tre CE a valenza nazionale (CEN). Mediante Decreto del Ministro della Salute del 1° febbraio 2022 sono stati istituiti i tre CEN (5):
- Comitato etico nazionale per le sperimentazioni cliniche in ambito pediatrico, presso l’Agenzia italiana del farmaco (AIFA);
- Comitato etico nazionale per le sperimentazioni cliniche relative a terapie avanzate (Advanced Medicinal Therapeutical Products, ATMP), presso l’AIFA;
- Comitato etico nazionale per le sperimentazioni cliniche degli enti pubblici di ricerca (EPR) e altri enti pubblici a carattere nazionale (CEN), presso l’ISS (CEN EPR).
Il CEN EPR si è insediato il 23 marzo 2022, venendo di fatto a sostituire il ruolo del CE ISS e allargando l’ambito di competenza dell’ex CE ISS alle ricerche provenienti da altri enti a carattere nazionale e in particolare da EPR. Il CEN EPR, come gli altri CEN e come i CET, è competente in via esclusiva per la valutazione dei seguenti tre tipi di studi condotti da EPR e da altri enti pubblici a carattere nazionale:
- sperimentazioni cliniche ai sensi del Regolamento UE 2014/536 (2);
- indagini cliniche sui dispositivi medici ai sensi del Regolamento UE 2017/745 (6);
- studi osservazionali farmacologici ai sensi del Decreto del Ministero della Salute 30 novembre 2021 (7).
Inoltre, il CEN EPR valuta protocolli di altri studi (ad esempio, clinici, osservazionali, diagnostici, di sanità pubblica, con l’utilizzo di materiale biologico umano, con implicazioni di etica ambientale), in particolare a carattere nazionale, effettuati da EPR e da altri enti pubblici a carattere nazionale e da enti privati.
Per le sperimentazioni cliniche con medicinali l’emissione dei pareri avviene, come per tutti i CE, tramite la piattaforma Clinical Trials Information System, CTIS (https://euclinicaltrials.eu/).
Per gli studi osservazionali farmacologici retrospettivi notificati che non richiedono il Consenso Informato, il CEN EPR esprime, in genere, una presa d’atto. Per alcune tipologie di richieste il CEN EPR rilascia una dichiarazione di assenza di criticità. Per tutti gli altri progetti, in seguito alla discussione in seduta plenaria, il CEN EPR esprime i seguenti tipi di pareri:
- approvazione (con eventuali raccomandazioni e/o suggerimenti);
- approvazione condizionata alla richiesta di modifiche e/o integrazioni;
- sospensione con indicazione di modifiche e/o integrazioni;
- non approvazione.
Il presente lavoro ha lo scopo di censire le attività di valutazione compiute dal CE ISS e dal CEN EPR rispettivamente dal 1° gennaio 2021 al 21 marzo 2022 e dal 23 marzo 2021 al 31 dicembre 2023 e di descrivere le caratteristiche degli studi censiti verificando anche se, e in che modo, il passaggio dal CE ISS al CEN EPR abbia determinato un cambiamento nelle tipologie di ricerche esaminate.
Materiali e metodi
Le ricerche valutate dal CE ISS e dal CEN EPR sono descritte a partire da un insieme di informazioni predefinite estratte dai protocolli di studio e dalle schede riassuntive degli studi. Le informazioni sono categorizzate come segue:
- anno di presentazione della richiesta di valutazione;
- tipologia di richiesta: prima valutazione, valutazione in seguito a richiesta di modifiche, emendamento, altro/notifiche, richieste varie;
- ruolo svolto dall’ISS: nessuno, coordinatore, co-coordinatore, collaboratore;
- copertura geografica: internazionale, nazionale, locale/regionale;
- tipologia di studio proposto (descritto di seguito);
- ente finanziatore: nessun fondo, bandi ISS, Ministero della Salute/Ministero dell'Istruzione e del Merito (MIUR), Unione Europea (UE), UE (Commissione Europea), UE (Piano Nazionale di Ripresa e Resilienza, PNRR), associazionismo, industria, fondazioni, istituti di ricerca/ università, AIFA, governo;
- importo del finanziamento. Ammontare totale nelle seguenti classi di finanziamento: ≤35.000, 40.000-140.000, 150.000-490.000, 500.000 e oltre, dato non disponibile.
Per quanto riguarda le tipologie di studio, sono state prese in considerazione solo quelle relative alle richieste di valutazione per i nuovi studi (prime valutazioni) secondo le seguenti categorie:
- studi in vitro o ex vivo, cioè ricerca di base sperimentale con raccolta/riuso di campioni biologici;
- studi interventistici e osservazionali, categorizzati secondo i due ampi indirizzi dell’epidemiologia distinti in base al fatto che l’intervento/esposizione sia assegnato in maniera attiva o meno dal ricercatore alla popolazione in studio (8);
- creazione di registri di patologia;
- studi qualitativi (ad esempio, focus group), secondo la definizione di Pope e Mays (9);
- studi mixed method (studi quali-quantitativi), comprendenti quegli studi che sono al contempo osservazionali e qualitativi;
- altro disegno.
Gli studi osservazionali sono stati ulteriormente divisi nelle seguenti categorie:
- studi osservazionali su farmaci ai sensi del DM 30 novembre 2021 (7), della Determina AIFA 20 marzo 2008 (10) e della Determina AIFA 8 agosto 2024 (11);
- studi osservazionali con dispositivo medico - indagini cliniche Post Market Clinical Follow Up (PMCF) ai sensi del Regolamento UE 2017/745 (MDR) art. 74 (6, 12);
- studi analitici con raccolti dati demografici e clinici;
- studi analitici con raccolta di dati demografici, clinici e campioni biologici;
- studi di prevalenza di patologie;
- indagini su conoscenze, attitudini, pratiche (survey);
- sorveglianze;
- altre tipologie di studi osservazionali.
Gli studi interventistici sono stati suddivisi nelle seguenti categorie:
- sperimentazioni cliniche di medicinali per uso umano (ai sensi del Regolamento UE 2014/536) (2);
- indagini cliniche su dispositivi medici (ai sensi del Regolamento UE 2017/745) (6);
- altre tipologie di studi interventistici (ad esempio, non farmacologici, ambientali) con raccolta dati demografici e clinici;
- altre tipologie di studi interventistici (ad esempio, non farmacologici, ambientali) con raccolta dati demografici, clinici e campioni biologici;
- altre tipologie di studi interventistici (ad esempio, non farmacologici, interventi di formazione).
Per quanto riguarda le categorie di salute/ malattia e i principali ambiti delle attività di ricerca, è stato utilizzato l’Health Research Classification System (13). Tale classificazione, elaborata dall’UK Clinical Research Collaboration per monitorare gli investimenti di ricerca di alcuni dei principali enti finanziatori nel Regno Unito (14), comprende due principali classificazioni della ricerca: la prima è centrata sulle categorie di salute/malattia (health category) e la seconda sull’attività di ricerca (research activity).
Le categorie di salute/malattia sono suddivise in: sangue, cancro e neoplasie, cardiovascolare, patologie congenite, orecchio, occhio, infezioni, sistema infiammatorio e immunitario, traumi ed incidenti, salute mentale, patologie metaboliche ed endocrine, muscoloscheletrico, neurologia, cavo orale e gastroenterico, renale e urogenitale, salute riproduttiva e percorso nascita, respiratorio. Le attività di ricerca sono invece suddivise in:
- ricerca di base;
- ricerca eziologica;
- prevenzione di malattie e condizioni, promozione salute/benessere;
- identificazione, screening, diagnosi;
- sviluppo di interventi e trattamenti terapeutici;
- valutazione di interventi e trattamenti terapeutici;
- gestione di patologie e condizioni ricerca servizi sociosanitari.
SG e CM hanno effettuato l’estrazione dei dati a partire dai protocolli e dalle schede riassuntive degli studi e dai pareri espressi da CE ISS e CEN EPR e li hanno inseriti in un foglio di lavoro Excel. È stata compiuta un’analisi descrittiva in numeri assoluti e percentuali; i dati sono stati inoltre stratificati per anno di presentazione della richiesta di valutazione (2021, 2022, 2023), per tipo di Comitato (CE ISS e CEN EPR) e per ruolo svolto dall’ISS nelle ricerche valutate.
Risultati
Tipologie di richiesta e pareri emessi
Nel periodo in studio sono state esaminate complessivamente 220 richieste di valutazione, distribuite per: valutazione di nuovi studi (n. 142), valutazione di modifiche a seguito di approvazione condizionata o sospensione (n. 37), emendamenti a studi già approvati (n. 35), altre tipologie di richieste (n. 6). Le tipologie di richieste risultano relativamente stabili negli anni con un lieve aumento delle valutazioni di nuovi studi e una leggera diminuzione nelle richieste di emendamento nel 2023 (Tabella 1).
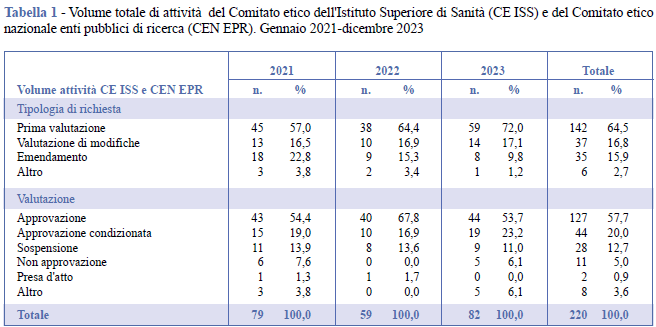
I pareri espressi da CE ISS e da CEN EPR nei tre anni in esame sono stati: approvazione (n. 127), approvazione condizionata a modifiche o integrazioni (n. 44), sospensione (n. 28), presa d'atto (n. 2), non approvazione (n. 11) e altro (n. 8). Il parere “presa d’atto” riguarda unicamente gli studi osservazionali farmacologici retrospettivi per i quali il Comitato riceve una notifica dallo sperimentatore. Anche per quanto riguarda le tipologie di valutazioni espresse dai componenti del CE ISS e del CEN EPR si nota una discreta stabilità negli anni (Tabella 1).
Nelle analisi che seguono sono considerate unicamente le richieste di valutazione dei nuovi studi (n. 142), e non sono dunque considerati gli emendamenti e le altre tipologie di richieste.
Ricerche valutate per copertura geografica e finanziamento
La maggior parte delle ricerche valutate negli anni dal 2021 al 2023 ha avuto una copertura geografica nazionale (n. 88; 62%), regionale o locale (n. 32; 4%), e solo in piccola parte internazionale (n. 8; 5,6%).
La maggior parte delle ricerche valutate sono state condotte senza fondi dedicati (n. 36; 25,4%) mentre la fonte di finanziamento extramurale più frequente è stata quella del Ministero della Salute (n. 33; 23,2%), seguita da fondi dedicati ISS (n. 16; 11,3%) e da fondi dell’UE PNRR (n. 13; 9,2%) relativi, tuttavia, solo all’ultimo anno di analisi. In misura minore sono presenti fondi provenienti da associazionismo (n. 11; 7,7%), industria (n. 9; 6,3%), UE (n. 8; 7,5%), fondazioni (n. 6; 4,2%), istituti di ricerca/università (n. 5; 3,5%), AIFA (n. 3; 2,1%), altri ministeri (n. 2; 1,4%) (Materiale Aggiuntivo - Tabella 1).
Per gli 88 studi per i quali è stato possibile rilevarne l’entità, il finanziamento complessivo è stato pari a un totale di 43.568.681 euro nell’intero periodo. Le organizzazioni che hanno finanziato il più elevato numero di studi con importi superiori a 490.000 euro sono state l’UE con fondi PNRR e non PNRR (rispettivamente 5 e 4 studi) e il Ministero della Salute/MIUR (Materiale Aggiuntivo - Tabella 1).
La ricerca: tipologie di studi, di ricerca e di aree di salute
Gli studi proposti alla valutazione di entrambi i Comitati sono stati in larga maggioranza di tipo osservazionale (66,2%; n. 94), seguiti da studi in vitro (12,7%; n. 18) e interventistici (8,5%; n. 12). La creazione di registri di patologia, la conduzione di studi qualitativi e mixed method sono rappresentati con percentuali, rispettivamente, del 4,9%, 4,2% e 3,5% (Tabella 2).
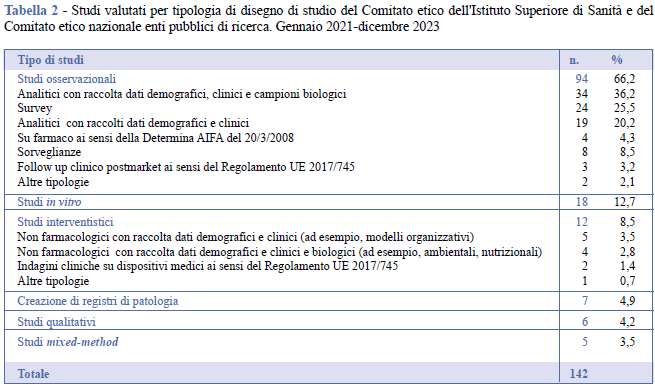
Fra gli studi osservazionali, le percentuali più elevate hanno riguardato gli studi osservazionali con raccolta di dati demografici, clinici e raccolta e uso/riuso di campioni biologici (36,2%) e gli osservazionali analitici con la sola raccolta di dati demografici e clinici (20,2%). Quattro richieste di valutazione hanno riguardato studi osservazionali su farmaco ai sensi della Determina AIFA del 20/3/2008 e tre studi di follow up clinico post market (PMCF) ai sensi del Regolamento UE 2017/745.
Per quanto riguarda l’esiguo numero di studi interventistici, nel periodo in esame il CE ISS e il CEN EPR non hanno ricevuto richieste di valutazione per sperimentazioni cliniche di medicinali per uso umano. Le richieste hanno riguardato interventi non farmacologici, ad esempio di valutazione di interventi di tipo formativo o di modelli di assistenza sanitaria, sia quelli limitati alla raccolta di dati demografici clinici (3,5%) sia quelli che includono anche la raccolta di campioni biologici (2,8%). Due richieste di valutazione hanno riguardato indagini cliniche su dispositivi medici ai sensi del Regolamento UE 2017/745 (Tabella 2). Non è stata sottoposta alla valutazione del CEN nessuna sperimentazione clinica di medicinali per uso umano (ai sensi del Regolamento UE 2014/536).
Nel Materiale Aggiuntivo - Tabella 2 sono mostrati i dati relativi alla distribuzione degli studi valutati per categoria di salute e tipologia di attività di ricerca. Si osserva che la categoria di salute/malattia più rappresentata negli studi analizzati è quella delle patologie infettive (25,4%), seguita dalla categoria “aree di salute non specifiche” (19,0%), che comprendono sia interventi generici di prevenzione primaria e promozione della salute, sia interventi di formazione per medici di medicina generale e studenti, sia ricerca su standard di sanità pubblica nei centri di detenzione per migranti. Seguono le patologie neurologiche e congenite con percentuali pari all’11,3%. Inoltre, nel complesso, l‘attività di ricerca è stata prevalentemente di tipo eziologico (44% degli studi), mentre percentuali molto più basse sono state osservate negli studi dedicati allo sviluppo e alla valutazione di interventi (4,9%) e a trattamenti terapeutici (2,8%) (Materiale Aggiuntivo - Tabella 2).
Le patologie infettive sono state studiate prevalentemente con un intento di tipo eziologico (27,7% degli studi) così come le patologie congenite (19%); le “aree di salute non specifiche” sono state indagate principalmente a scopo preventivo e di promozione della salute (58,8%), e le patologie neurologiche con l'obiettivo di migliorarne la gestione (25% degli studi) (Materiale Aggiuntivo - Tabella 2).
Le aree di salute non specifiche sono la categoria sanitaria che ha ricevuto l’importo di finanziamento più elevato, pari al 40,6% del finanziamento totale (17.675.306 di euro). Le patologie infettive hanno ricevuto il 13,2% del totale, le metaboliche/endocrine e la salute mentale hanno ricevuto importi pari all’11% del totale, con circa 5 milioni di euro. Da notare che il budget delle patologie metaboliche ed endocrine si riferisce a un unico studio finanziato (Materiale Aggiuntivo - Tabella 3).
Il ruolo dell’ISS nelle ricerche valutate e le tematiche affrontate
Nel periodo di riferimento, il numero totale dei progetti in cui l’ISS risulta coinvolto è pari a 120 (84,5%), nella maggior parte dei casi con un ruolo di coordinatore (69%), seguito da quello di co-coordinatore (12,7%) e collaboratore (2,8%). I principali partner nelle ricerche co-coordinate dall’ISS o in cui ISS è collaboratore sono le università, le organizzazioni del Servizio Sanitario Nazionale (SSN), le associazioni senza scopo di lucro e, occasionalmente, Regioni, società scientifiche e altri EPR (Tabella 3). Le ricerche in cui l'ISS non ha ricoperto alcun ruolo sono state prevalentemente coordinate da altri EPR, industria, università e in un solo caso da una organizzazione dell'SSN.
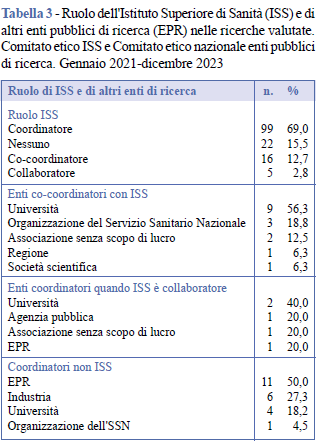
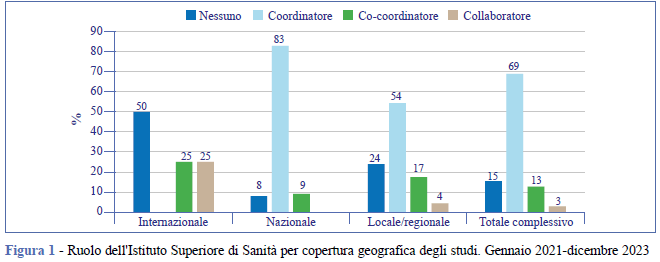
Le ricerche in cui l’ISS ha svolto un ruolo di coordinatore sono state prevalentemente ricerche con copertura geografica nazionale (n. 73), mentre nelle ricerche internazionali l’ISS non ha svolto alcun ruolo (n. 4), ha svolto un ruolo di co-coordinatore (n. 2) o di collaboratore (n. 2) (Figura 1).
I tipi di ricerche in cui l’ISS ha svolto più spesso un ruolo da coordinatore sono stati studi osservazionali (66,3%), studi in vitro (14,3%) e registri di patologia (7%), mentre ha coordinato meno spesso studi di tipo interventistico (5%) (Figura 2).
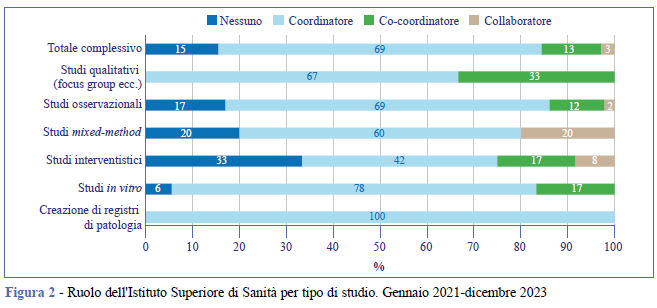
Il totale di finanziamenti ricevuti dall’ISS con ruolo di coordinatore, co-coordinatore e collaboratore è stato pari a 33.901.604 di euro (dato non mostrato). Gli studi in cui l’ISS ha avuto un ruolo da coordinatore sono stati più spesso finanziati con fondi del Ministero della Salute (27,3%), nessun fondo (24,2%), bandi interni ISS (14,1%), associazionismo (12,5%) e altri fondi (Figura 3).
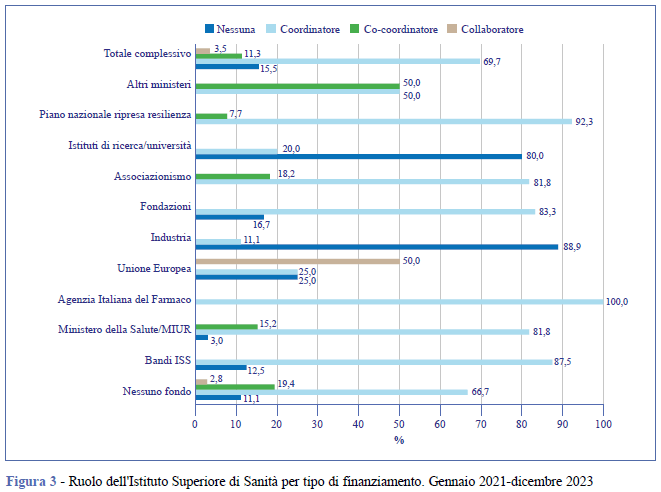
La categoria sanitaria che ha ricevuto il maggior finanziamento negli studi in cui l’ISS ha avuto un qualsiasi ruolo è quella delle “aree di salute non specifiche”. Nelle cinque posizioni successive, con un'entità di finanziamento complessiva pari al 66% del totale, si collocano le infezioni, le patologie metaboliche, il cancro e le neoplasie, la salute mentale e le patologie neurologiche (Materiale Aggiuntivo - Tabella 4).
Si osserva, inoltre, che le aree di salute maggiormente rappresentate sono le patologie infettive con un totale di 21 studi, le aree di salute non specifiche (n. 17 studi), le patologie neurologiche (n. 16 studi) e le patologie congenite (n. 10 studi) (Materiale Aggiuntivo - Tabella 4).
Passaggio da CE ISS a CEN EPR
Il CE ISS e, in seguito, il CEN EPR hanno mantenuto relativamente stabile la propria mole di attività nel periodo in esame (Tabella 1), con un leggero aumento durante il mandato del CEN EPR delle richieste di valutazione proveniente da enti esterni all’ISS e dunque di studi in cui l’ISS non ha alcun ruolo (dal 10% al 18%) e un leggero calo degli studi in cui ISS ha un ruolo di coordinamento (da 72,9% a 68,1%) (Materiale Aggiuntivo - Tabella 5).
Per quanto riguarda le tipologie di studi da valutare, nel passaggio da CE ISS a CEN EPR si è assistito a un leggero calo degli studi osservazionali (da 68,8% a 64,9%) e qualitativi (da 8,3% a 2,1%) e a un aumento degli studi in vitro (da 8,3% a 14,9%) e interventistici (da 6,3% a 9,6%). In lieve aumento anche le richieste di valutazione di registri di patologia (da 4,2% a 5,3%) (Materiale Aggiuntivo - Tabella 5), che presentano peculiarità differenti rispetto, ad esempio, agli studi osservazionali di altro tipo (15).
Durante il mandato del CEN EPR si assiste, inoltre, a un leggero calo delle ricerche condotte con nessun fondo (dal 35,4% al 20,2%), con fondi ISS o del MIUR (dal 22% al 17%) e a un aumento in proporzione delle altre tipologie di finanziamento, inclusi finanziamenti privati (dal 2% al 7%).
Per quanto riguarda l’entità dei finanziamenti degli studi, nel passaggio da CE ISS a CEN EPR si assiste a un aumento dei finanziamenti con importo >490.000 euro, aumento dovuto alla presenza durante il mandato del CEN EPR dei finanziamenti del PNRR (13,8%) ma anche ad altre tipologie, tra cui UE (6,4%), industria (7,4%) e finanziamenti di altro tipo (Materiale Aggiuntivo - Tabella 5).
Discussione
Il presente studio analizza per la prima volta l’attività di valutazione negli ultimi 15 mesi di attività del CE ISS e dei primi 22 mesi di attività del CEN EPR. Nei tre anni analizzati sono stati valutati dal CE ISS e dal CEN EPR complessivamente 142 progetti.
Gli studi valutati dai Comitati sono stati principalmente di tipo osservazionale, mentre gli studi interventistici hanno rappresentato una quota minoritaria. L’area di salute maggiormente esplorata è stata quella delle patologie infettive, mentre i finanziamenti più consistenti hanno riguardato la categoria delle “aree di salute non specifiche”, legata prevalentemente all’attività di ricerca “prevenzione di malattie e condizioni, promozione salute/benessere”.
Meno esplorate ma comunque presenti, con una percentuale di studi inferiore al 5%, sono le patologie del sistema infiammatorio/ immunitario, dell’apparato respiratorio e sistema muscoloscheletrico, le patologie dell’occhio, metaboliche ed endocrine, i traumi e gli incidenti, l’area ematologica e quella della salute riproduttiva e del percorso nascita.
La maggioranza delle ricerche valutate dal CE ISS e dal CEN EPR ha avuto come ente coordinatore l’ISS, una copertura geografica prevalentemente a livello nazionale e un finanziamento con fondi pubblici.
Il passaggio da CE ISS a CEN EPR ha, tuttavia, inevitabilmente determinato un aumento delle richieste di valutazione da parte degli enti esterni all’ISS e di ricerche in cui l’ISS non svolge alcun ruolo, con finanziamenti provenienti da soggetti pubblici e privati, incluse industria e fondazioni.
I componenti e la segreteria del CEN EPR si confrontano con queste nuove richieste e con le specificità che i protocolli di ricerca comportano sia da un punto di vista metodologico che regolatorio. È dunque importante che i componenti e la segreteria del CEN EPR possano affiancare al compito di istruttoria e valutazione dei progetti anche momenti di formazione e confronto interni al CEN EPR, con altri CE e con i ricercatori che presentano i progetti. È ugualmente importante che il CEN EPR monitori la propria attività, in modo da poter gestire le valutazioni secondo criteri il più possibile imparziali e oggettivi, rimanendo costantemente aggiornato circa le innovazioni tecnologiche, metodologiche e regolatorie di una ricerca in continua evoluzione.
Il CEN EPR, essendo collocato presso l’ISS, rappresenta anche un punto di osservazione privilegiato di buona parte della ricerca condotta in ISS, in particolare della ricerca che coinvolge esseri umani. Con il passaggio da CE ISS a CEN EPR, l’osservazione è arricchita dal confronto con la ricerca condotta presso altri EPR e altre strutture, con la possibilità di descrivere, nel confronto, le specificità dell’ente, i suoi punti di forza e, eventualmente, gli aspetti su cui si potrebbe investire per meglio rispondere alle necessità conoscitive della sanità pubblica a livello nazionale e internazionale.
Per avere una visione più completa della ricerca condotta in ISS e di quella a cui l’ISS partecipa, sarebbe necessario collaborare con altri enti di valutazione, come il Centro per la Sperimentazione e il Benessere Animale dell'ISS, con altri CE che valutano studi a cui l’ISS partecipa come collaboratore. Un adeguato sistema di “ricerca sulla ricerca” dovrebbe mettere in rete i CE operativi a livello regionale e nazionale, per rilevare in modo il più standardizzato e confrontabile possibile l’attività di valutazione e i suoi risultati.
Conclusioni
Con la presente analisi di epidemiologia della ricerca, la prima di una serie che si intende proseguire negli anni a venire, si è cercato di capitalizzare il lavoro dei componenti e della segreteria del CE ISS e del CEN EPR rendendo disponibile una descrizione degli studi valutati, ritenendo l’informazione potenzialmente utile alla governance della ricerca condotta presso l’ISS e altri EPR in Italia.
I sistemi di valutazione (ex ante ed ex post) degli studi sono fondamentali per un’adeguata governance della ricerca. Tuttavia, gli stessi sistemi di valutazione non possono prescindere dalla definizione di obiettivi programmatici di breve e lungo periodo che devono essere basati sull’osservazione di quanto già avviene da parte delle istituzioni che finanziano e/o svolgono la ricerca e dagli stessi ricercatori (16).
l CE rappresentano un punto di osservazione privilegiato della ricerca con persone condotta in Italia. Pertanto, dovrebbero dotarsi di sistemi di raccolta delle informazioni il più possibile standardizzati e tra loro coordinati, per rispondere all’invito dell’Organizzazione Mondiale della Sanità a sviluppare osservatori nazionali per la ricerca sanitaria e contribuire all'identificazione di lacune e opportunità per la ricerca stessa (17).
Conflitti di interesse dichiarati: nessuno.
Finanziamenti: nessuno.
Authorship: tutti gli autori hanno contribuito in modo significativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- World Health Organization. Research ethics committees: basic concepts for capacity-building Geneva, Switzerland: WHO; 2009. www.who.int...; ultimo accesso 14/1/2025.
- European Union. Regulation (EU) No 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/ EC. Official Journal of the European Union L 158/1 del 27 maggio 2014.
- Italia. Ministero della Sanità. Decreto 18 marzo 1998. Linee guida di riferimento per l’istituzione e il funzionamento dei comitati etici. Gazzetta Ufficiale - Serie Generale n. 122, 28 maggio 1998.
- Italia. Legge 11 gennaio 2018, n. 3. Delega al Governo in materia di sperimentazione clinica di medicinali nonché disposizioni per il riordino delle professioni sanitarie e per la dirigenza sanitaria del Ministero della Salute. Gazzetta Ufficiale - Serie Generale n. 25, 31 gennaio 2018.
- Italia. Ministero della Salute. Decreto 1 febbraio 2022. Individuazione dei comitati etici a valenza nazionale. Gazzetta Ufficiale - Serie Generale n. 63, 16 marzo 2022.
- European Union. Regulation (EU) 2017/745 of the European Parliament and of the Council of 5 April 2017 on medical devices, amending Directive 2001/83/EC, Regulation (EC) No 178/2002 and Regulation (EC) No 1223/2009 and repealing Council Directives 90/385/EEC and 93/42/EEC. Official Journal of the European Union L 117/1, 5th May 2017.
- Italia. Ministero della Salute. Decreto 30 novembre 2021. Misure volte a facilitare e sostenere la realizzazione degli studi clinici di medicinali senza scopo di lucro e degli studi osservazionali e a disciplinare la cessione di dati e risultati di sperimentazioni senza scopo di lucro a fini registrativi, ai sensi dell'art. 1, comma 1, lettera c), del decreto legislativo 14 maggio 2019, n. 52. Gazzetta Ufficiale - Serie Generale n. 42, 19 febbraio 2022.
- Grimes DA, Schulz KF. An overview of clinical research: the lay of the land. Lancet 2002;359(9300):57-61. doi: 10.1016/S0140- 6736(02)07283-5
- Pope C, Mays N. Reaching the parts other methods cannot reach: an introduction to qualitative methods in health and health services research. BMJ 1995;311(6996):42-5. doi: 10.1136/ bmj.311.6996.42
- Agenzia Italiana del Farmaco. Determina 8 agosto 2024. Linea guida per la classificazione e conduzione degli studi osservazionali sui farmaci. (Determina n. 425/2024). Gazzetta Ufficiale - Serie Generale n. 194, 20 agosto 2024.
- Agenzia Italiana del Farmaco. Determinazione 20 marzo 2008. Linee guida per la classificazione e conduzione degli studi osservazionali sui farmaci. Gazzetta Ufficiale - Serie Generale n. 76, 31 marzo 2008.
- Italia. Decreto legislativo 5 agosto 2022, n. 137. Disposizioni per l'adeguamento della normativa nazionale alle disposizioni del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il Regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio, nonche' per l'adeguamento alle disposizioni del regolamento (UE) 2020/561 del Parlamento europeo e del Consiglio, del 23 aprile 2020, che modifica il regolamento (UE) 2017/745 relativo ai dispositivi medici, per quanto riguarda le date di applicazione di alcune delle sue disposizioni ai sensi dell'articolo 15 della legge 22 aprile 2021, n. 53. Gazzetta Ufficiale - Serie Generale, n. 214, 13 settembre 2022.
- UK Clinical Research Collaboration. Health Research Classification System.-February 2018. hrcsonline.net/...; ultimo accesso 14/1/2025.
- Carter JG, Sherbon BJ, Viney IS. United Kingdom health research analyses and the benefits of shared data. 2016;14(1):48. doi: 10.1186/s12961-016-0116-1
- Gainotti S, Torreri P, Mannelli C, Cagnazzo C, Ficara B, Petrini C. Registries or non-pharmacological observational studies? An operational attempt to draw the line and to provide some suggestions for the ethical evaluation of rare disease registries. Ann Ist Super Sanità 2024;60(1):29-36. doi: 10.4415/ANN_24_01_05
- Morciano C, Errico MC, Faralli C, Minghetti L. An analysis of the strategic plan development processes of major public organisations funding health research in nine high-income countries worldwide. Health Res Policy Syst 2020;18:106. doi: 10.1186/s12961-020-00620-x
- World Health Organization. Guidance for best practices for clinical trials. Geneva: World Health Organization; 2024.

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale