I casi di legionellosi segnalati al sistema di sorveglianza nazionale. Italia, 2024
Benedetta Bellinia, Andrea Cannonea, Giulia Faddaa, Maria Scaturroa, Fabiola Mancinia, Antonino Bellaa, Stefania Giannitellia, Roberta Urciuolia, Riccardo Mimmoa,b, Patrizio Pezzottia, Jessica Ieraa, Maria Luisa Riccia
a Dipartimento di Malattie Infettive, Istituto Superiore di Sanità, Roma
b Dipartimento di Scienze della Sanità Pubbliche e Pediatriche, Università di Torino
Citare come segue: Bellini B, Cannone A, Fadda G, Scaturro M, Mancini F, Bella A, Giannitelli S, Urcioli R, Mimmo R, Pezzotti P, Iera J, Ricci M.L. I casi di legionellosi segnalati al sistema di sorveglianza nazionale. Italia, 2024. Boll Epidemiol Naz 2025;6(2):9-18. DOI: https://doi.org/10.53225/BEN_107
The national Legionnaires' Disease Surveillance System in Italy: 2024 data
Introduction
Legionnaires’ Disease (LD) is a severe form of pneumonia caused by the Legionella genus, primarily by Legionella pneumophila (L. pneumophila), that typically affects older adults and individuals with chronic conditions. In Italy, LD is a notifiable disease that is monitored through the mandatory national surveillance system, which is coordinated by the Istituto Superiore di Sanità (ISS) and integrated with microbiological data from the National Reference Laboratory (NRL). This report summarises the results of the 2024 surveillance.
Materials and methods
The national surveillance system collects case-based reports from local health authorities and hospitals. Submitted report forms are reviewed in order to assess clinical manifestations, confirm the aetiological agent and identify potential sources of infection. Cases are classified according to the EU case definition of 2018 and WHO guidelines. The NRL provides identification and typing of clinical and environmental isolates through phenotypic and genomic methods to support cluster and outbreak investigations. It confirms clinical diagnoses using culture, urinary antigen testing, serology, Real-Time PCR, and other nucleic acid amplification and sequencing tests.
Results
In 2024, 4,627 LD cases were reported in Italy (78.5 cases per million inhabitants), representing an 18.0% increase compared to 2023. The highest incidence rates were seen in the northern regions, among males (65.3%) and individuals aged 60 years and over (75.4%). The majority of cases were community-acquired (82.6%), followed by travel-associated (8.9%) and nosocomial infections (3.4%). The case fatality rate was 13.6%. The diagnosis was mainly relied on urinary antigen testing (96.0%). The NRL characterised 52 human L. pneumophila isolates, with ST23, ST37 and ST1 most frequently detected, and identified 503 environmental isolates. A major cluster involving 91 cases was detected in northern Italy, with molecular evidence linking clinical and household water isolates. An increase in cases was observed from summer to autumn, peaking in September and October.
Conclusions
The increasing incidence of LD confirms a growing public health burden in Italy. Integrated epidemiological and microbiological surveillance is essential for the early detection of clusters and for the implementation of effective control measures. Key actions to improve prevention include strengthening Water Safety Plans, enforcing current legislation, and enhancing laboratory capacity.
Key words: Legionnaires’ disease; surveillance; epidemiology
Introduzione
La legionellosi è una forma di polmonite interstiziale che viene solitamente acquisita tramite inalazione di aerosol (ad esempio generato da docce, nebulizzatori, vasche idromassaggio o torri di raffreddamento per impianti di climatizzazione, fontane, apparecchiature per terapia inalatoria) o, meno frequentemente, tramite aspirazione di acqua contaminata da batteri appartenenti al genere Legionella. L'infezione da Legionella non viene trasmessa da persona a persona, benché sia stato descritto un possibile caso di trasmissione interumana nel 2016 (1). La malattia ha obbligo di notifica sia in Italia che nella maggior parte dei Paesi europei.
Tra tutti i patogeni presenti nell’acqua, secondo l’Organizzazione Mondiale della Sanità (OMS), Legionella è quello che causa il maggior onere sanitario nell’Unione Europea. Il nostro Paese, in accordo con l'European Centre for Disease Prevention and Control - ECDC e con l’OMS raccomanda di mettere in atto adeguate misure di controllo degli impianti idraulici per prevenire i casi di legionellosi nelle strutture di ricezione turistica, negli ospedali, nelle strutture sanitarie di lunga degenza o in altri contesti (come ad esempio torri di raffreddamento) cui possano essere esposti ampi gruppi di popolazione anche ad alto rischio (2).
In Italia esiste un sistema nazionale di sorveglianza della legionellosi coordinato dal Dipartimento di Malattie Infettive dell’Istituto Superiore di Sanità (ISS). I casi vengono notificati dalle Aziende Sanitarie Locali, dalle Regioni/ Province Autonome al sistema di sorveglianza nazionale. Gli obiettivi del sistema di sorveglianza riguardano il monitoraggio dei casi di malattia sia dal punto di vista epidemiologico che clinico, con particolare attenzione ai fattori di rischio per l'acquisizione della malattia e l’identificazione delle eventuali variazioni nell’andamento della malattia.
In questo lavoro vengono presentati i risultati dell’analisi dei dati relativi ai casi di legionellosi notificati al sistema nazionale di sorveglianza nel 2024. Vengono, inoltre, descritti i dati relativi ai casi per i quali il Laboratorio Nazionale di Riferimento per le Legionelle (LNR) del Dipartimento di Malattie Infettive dell’ISS ha ricevuto campioni clinici o ceppi isolati per la conferma diagnostica.
Materiali e metodi
Il sistema di sorveglianza nazionale della legionellosi
Il sistema di sorveglianza nazionale della legionellosi, coordinato dal Dipartimento di Malattie Infettive dell’ISS, è attivo dal 1983 e raccoglie informazioni specifiche relativamente al quadro clinico, all'accertamento eziologico e alla possibile fonte di infezione per ogni caso di legionellosi diagnosticato sul territorio nazionale. Il medico che pone la diagnosi di legionellosi ha l’obbligo di compilare la relativa scheda di sorveglianza e di inviarla alla ASL di competenza territoriale e al Dipartimento di Malattie Infettive dell’ISS entro 48 ore (3). Nell’ambito della sorveglianza viene utilizzata la definizione di caso aggiornata in accordo con la Decisione della Commissione Europea 2018/945 del 22 giugno 2018 (4). Per i casi nosocomiali, probabili o confermati, viene utilizzata la definizione di caso in accordo con le linee guida per la prevenzione e il controllo della legionellosi (3).
Registrazione e conservazione di ceppi, campioni clinici e ambientali
L’LNR riceve campioni clinici dai laboratori di riferimento per la diagnosi clinica della legionellosi e da altri laboratori ospedalieri per accertamenti diagnostici (5); riceve, inoltre, dai laboratori di riferimento regionali i ceppi isolati dall’ambiente associati a cluster. In collaborazione con le ASL e le Regioni/Province Autonome, l'LNR interviene in caso di cluster o epidemie che si verificano nel territorio nazionale analizzando anche campioni d’acqua ed effettuando tutte le analisi di confronto tra i ceppi ambientali e clinici per risalire all’origine dell’infezione. Al momento del ricevimento, tutti i campioni/ceppi vengono registrati in un database centralizzato inserendo, per ciascun campione/ceppo, le informazioni disponibili e, dopo aver effettuato tutte le analisi necessarie, vengono conservati a -80 °C.
Analisi di laboratorio
Esame colturale - Tutti i campioni di origine umana vengono analizzati mediante esame colturale in accordo con quanto riportato nell’Allegato 2 delle Linee guida per la prevenzione e il controllo della legionellosi (3). I campioni di origine ambientale sono analizzati in accordo con la norma ISO 11731: 2017 (6).
Real Time PCR - Le secrezioni respiratorie ricevute nel corso del 2024 sono state analizzate per la presenza di DNA di Legionella pneumophila mediante Real Time PCR, utilizzando un protocollo elaborato da membri dell’ESCMID Study Group for Legionella infections (ESGLI) (7) e kit commerciali certificati CE (IVD) per la diagnosi di Legionella in campioni clinici. Per l’estrazione del DNA è stato utilizzato il DNeasy blood and tissue kit e il QIAamp DNA kit (QIAgen), usando per entrambi o il metodo manuale o quello automatizzato (QIAcube, QIAgen).
Tipizzazione genomica basata su sequenza (Sequence Based Typing) e tipizzazione fenotipica con anticorpi monoclonali (MAb typing) - I ceppi di L. pneumophila isolati sono stati tipizzati mediante Sequence-based Typing (SBT), attuale gold standard per la tipizzazione di ceppi di L. pneumophila, eseguita in accordo con il protocollo elaborato da membri dell’ESGLI (8, 9). La determinazione del singolo sierogruppo è stata eseguita mediante immunofluorescenza indiretta, utilizzando anticorpi monoclonali specifici (10).
Diagnosi in campioni di urine e sieri - Campioni di sieri sono stati analizzati per la determinazione del titolo anticorpale mediante immunofluorescenza indiretta, mentre campioni di urine sono stati analizzati per la presenza dell’antigene solubile di L. pneumophila mediante test immunocromatografico.
Analisi statistica
Nel presente lavoro sono stati analizzati tutti i casi di legionellosi notificati al sistema di sorveglianza nazionale con data di inizio dei sintomi compresa tra il 1° gennaio 2024 e il 31 dicembre 2024. I dati vengono descritti con frequenza assoluta e percentuale. È stato calcolato il tasso di incidenza (per milione di abitanti) di legionellosi in Italia utilizzando la popolazione Istat al 1° gennaio 2024 (demo.istat.it). L’incidenza di legionellosi è stata aggiustata per sesso e per età, con fasce decennali, utilizzando come riferimento la popolazione europea standard al 2013.
Le analisi statistiche sono state effettuate con il software statistico R (versione 4.4.0) e RStudio (versione 2024.09.1 +394).
Risultati
Nel 2024 sono stati notificati 4.627 casi di legionellosi, in accordo con la definizione di caso europeo del 2018 (4). L’81% dei casi è stato notificato da 6 Regioni (Lombardia, Emilia- Romagna, Lazio, Toscana, Veneto e Piemonte), e il restante 19% dalle rimanenti Regioni/Province Autonome.
L’incidenza grezza dei casi di legionellosi in Italia nel 2024 è risultata pari a 78,5 casi per milione di abitanti, con un incremento rispetto all’anno precedente (66,3/1.000.000), superiore anche ai valori precedenti la pandemia. L’incidenza aggiustata per età e sesso conferma la stessa tendenza di quella grezza, anche se con valori inferiori (Figura 1).
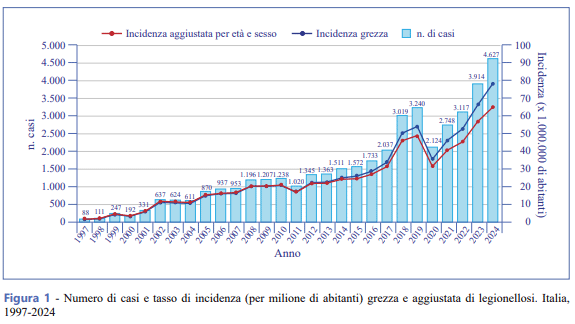
Analizzando i dati per area geografica, si continua a osservare un gradiente Nord-Sud con valori di incidenza grezza pari a 110,6 casi per milione al Nord, 95,6 per milione al Centro e 17,5 per milione al Sud.
La Figura 2 riporta l’incidenza grezza e aggiustata per età e sesso per Regione/Provincia Autonoma: i valori più elevati sono stati registrati in Lombardia, Emilia-Romagna e Toscana, mentre i valori più bassi in Sicilia, Calabria e Campania.

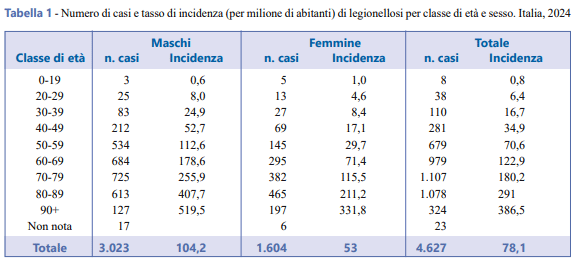
L’età media dei casi è pari a 69,9 anni con un range compreso tra 4 e 101 anni e il 75,4% dei casi ha almeno 60 anni. Il 65,3% dei casi di legionellosi è di sesso maschile e il rapporto maschi/femmine è di 1,9 a 1. In Tabella 1 viene riportato il numero di casi e il tasso di incidenza per classe di età e sesso.
Fattori di rischio e possibili esposizioni
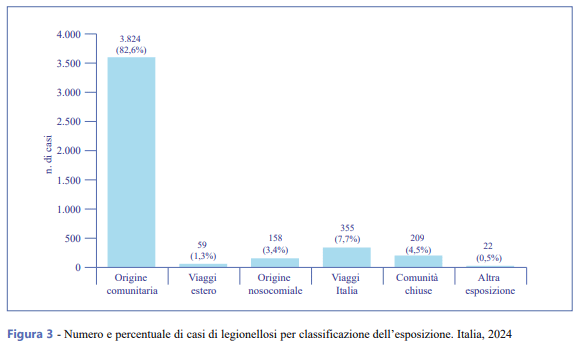
Il 17,4% dei casi ha presentato un’esposizione nei 10 giorni precedenti l’esordio della sintomatologia. In Figura 3 e Tabella 2 è riportata la distribuzione dei casi per classificazione in relazione all’esposizione. Dei 4.627 casi notificati, 355 (7,7%) avevano viaggiato in Italia e pernottato almeno una notte in luoghi diversi dall’abitazione abituale (alberghi, campeggi, navi, abitazioni private), 158 (3,4%) erano stati ricoverati in ospedale (origine nosocomiale), 209 (4,5%) appartenevano a comunità chiuse (case di riposo per anziani, residenze sanitarie assistenziali, strutture di riabilitazione), 59 (1,3%) avevano viaggiato e soggiornato all’estero, mentre 22 (0,5%) hanno presentato altro tipo di esposizione. L’82,6% (n. 3.824) dei casi è stato classificato come di origine comunitaria (ovvero di origine non nota), in quanto non è stato riportato alcun soggiorno al di fuori della propria abitazione durante il periodo di incubazione della malattia.
Il 74,6% dei pazienti presentava altre patologie concomitanti, prevalentemente di tipo cronicodegenerativo (48,4%: diabete, ipertensione arteriosa, broncopneumopatia cronica ostruttiva), neoplastico (8,2%), autoimmune (1,6%), trapianti (0,7%), infettivo (0,4%) e altre patologie (15,2%).
Stagionalità
Vengono riportati i casi di legionellosi per mese, suddivisi per Regione/Provincia Autonoma di notifica (Materiale Aggiuntivo - Figura). Sebbene vi siano delle oscillazioni tra le varie aree regionali, è possibile notare come la maggior parte dei casi sia concentrata nel periodo giugnodicembre, mentre nel restante periodo dell’anno i casi siano nettamente inferiori.
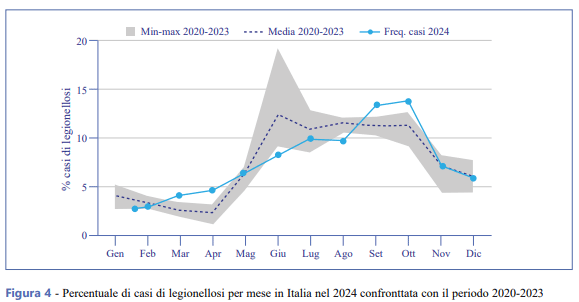
La Figura 4 mostra l’andamento della percentuale dei casi di legionellosi in Italia per mese di insorgenza dei sintomi nel 2024, paragonato al periodo dei quattro anni precedenti (2020-2023). Rispetto al quadriennio precedente, nel 2024 si osserva un maggior numero di casi per mese a marzo, aprile, settembre e ottobre e un minor numero di casi nel periodo estivo da giugno ad agosto.
Infezioni nosocomiali
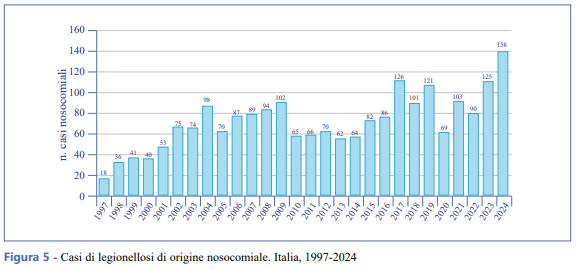
Nel 2024 sono stati segnalati 158 casi nosocomiali (3,4% dei casi totali notificati), di cui 143 (90,5%) di origine nosocomiale confermata e 15 (9,5%) di origine nosocomiale probabile. L’andamento dei casi di legionellosi di origine nosocomiale confermata o probabile dal 1997 al 2024 è illustrato nella Figura 5.
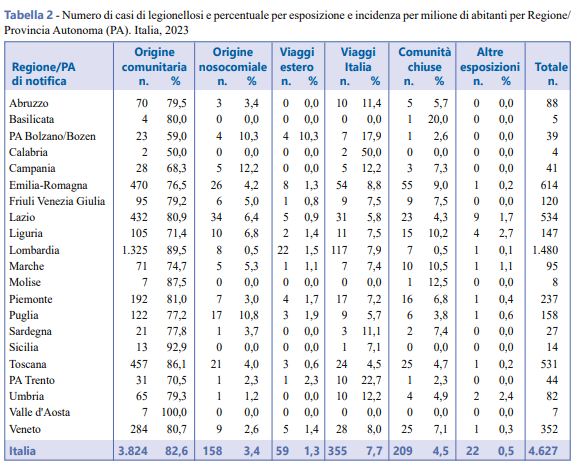
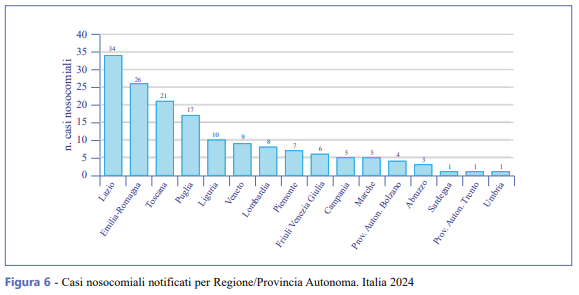
Il numero di casi nosocomiali è aumentato nel 2024 rispetto all’anno precedente e il 79,1% è stato notificato da sette Regioni: Lazio, Emilia-Romagna, Toscana, Puglia, Liguria, Veneto e Lombardia. Il numero di casi di origine nosocomiale confermata o probabile per Regione/Provincia Autonoma di notifica è riportato in Figura 6.
L’età media dei casi nosocomiali è di 72,8 anni (range: 4-96 anni); le patologie alla base del ricovero erano prevalentemente di tipo cronicodegenerativo (53,2%), seguite da neoplasie (26%) e altre patologie (5,6%).
Durata del ricovero ed esito della malattia
Esclusi i casi nosocomiali, la durata del ricovero ospedaliero è nota per il 35,1% (n. 1.571) dei casi ed è stata in media di 11,9 giorni (intervallo 0-86, DS 10,7).
L’esito della malattia è noto per il 45,2% (n. 2091) di tutti i casi; di questi, nell’86,4% (n. 1.807) dei casi è stata segnalata guarigione o miglioramento, mentre nel 13,6% (n. 284) dei casi il paziente è deceduto.
Criterio diagnostico
Sulla base di quanto riportato nella scheda di sorveglianza, il 96,9% dei casi è stato diagnosticato mediante un singolo test di laboratorio, il 2,8% tramite due test e il rimanente 0,3% tramite tre test. Il metodo diagnostico più frequentemente utilizzato è stato la rilevazione dell'antigene solubile urinario di L. pneumophila (96%), seguito nell’1,9% dei casi dalla PCR, nello 1,1% da singolo titolo elevato, nello 0,7% da esame colturale e nello 0,3% da immunofluorescenza.
L’LNR ha ricevuto complessivamente 73 campioni clinici, includendo 56 ceppi isolati, 17 secrezioni respiratorie. Le secrezioni respiratorie sono state saggiate per coltura e di queste 11 sono risultate negative e 6 positive (5 L. pneumophila sierogruppo 1 e 1 L. pneumophila sierogruppo 8). È stata utilizzata anche Real Time PCR per saggiare 15 delle 17 secrezioni respiratorie con risultati concordanti con l’esame colturale, tranne che per due campioni che sono risultati positivi in Real time PCR (L. pneumophila sierogruppi 2-15), ma sono risultati negativi alla coltura. Tra i ceppi pervenuti isolati su piastra, 10 non sono stati ulteriormente analizzati perché la subcoltura ha dato esito negativo. Complessivamente sono stati identificati e tipizzati 52 ceppi di origine umana: 41 erano Lp1, 4 Lp6, 2 Lp3, 2 Lp8, 2 Lp10, 1 Lp2-15. Quarantasei ceppi sono stati tipizzati mediante SBT e i seguenti Sequence Type (ST) sono stati determinati: ST23 (n. 5), ST37 (n. 4), ST1(n. 3), ST20 (n. 2) ST62 (n. 2) ST507 (n. 2).
Inoltre, l’LNR ha ricevuto 49 campioni di urine e 48 campioni di siero. Dei campioni di urine 26 sono risultati positivi; tutti i campioni di siero erano negativi tranne 5 che erano positivi alla diluizione 1:128 (n. 2), 1:256 (n. 2) e 1:512 (n. 1). Solo sei Regioni hanno inviato campioni clinici: Emilia- Romagna, Lazio, Lombardia, Marche, Province Autonome di Trento e Bolzano e Umbria.
L’LNR ha infine ricevuto 503 ceppi di origine ambientale isolati da impianti idrici di strutture turistico-recettive e da alcuni ospedali, dai seguenti laboratori di riferimento regionali: ARPA Lazio, ARPA Veneto, ARPA Basilicata, ATS-Brescia, APPA Bolzano, ARPA Campania, ARPAE Emilia-Romagna, ATS-Milano, ARPAE Bologna, AUSL Firenze, Università degli Studi di Bari, Ospedale Militare Celio (Roma), Ospedale San Camillo Forlanini (Roma), Policlinico A. Gemelli (Roma). Questi ceppi sono stati isolati a seguito di indagini effettuate per segnalazione di casi o di possibili cluster. Gli isolati di L. pneumophila sono stati identificati come appartenenti al sierogruppo 1 (n. 273) e sierogruppo 2-16 (n. 166) e i restanti appartenevano a specie di Legionella nonpneumophila (n. 34).
Casi associati a viaggio diagnosticati in Italia
I casi associati ai viaggi diagnosticati in Italia sono stati complessivamente 414 (8,9%). Tra questi, la maggior parte ha viaggiato in Italia (n. 355, 85,7%) mentre nel 14,3% (n. 59) dei casi la meta del viaggio è stata una località straniera. L’età media dei casi associati a viaggio e diagnosticati in Italia è stata di 64,4 anni (DS = 13,3). Le Regioni che hanno segnalato il maggior numero di casi sono state Lombardia (33,6%), Emilia-Romagna (15%), Lazio (8,7%) e Veneto (8%). Il tempo medio di soggiorno è stato di 6,4 giorni.
Conclusioni e raccomandazioni
Nel 2024 sono stati notificati al sistema di sorveglianza nazionale complessivamente 4.627 casi di legionellosi, con un incremento del 18,0% rispetto all'anno precedente (11). Si conferma quindi l’aumento osservato negli ultimi anni (ad eccezione del decremento osservato nel 2020, a causa della pandemia da COVID-19), nonostante la legionellosi sia considerata un’infezione sottostimata e, in alcune Regioni, non si possa ancora escludere una sottonotifica dei casi (12).
Tale andamento si osserva anche a livello europeo, come evidenziato dall’ECDC (12). Dal mese di aprile 2024 è stato rilevato un focolaio di infezione da L. pneumophila sierogruppo 1 (Lp1) che ha coinvolto fino a oggi (dicembre 2025) 96 persone residenti in due Comuni limitrofi in provincia di Milano: Corsico e Buccinasco. Le indagini epidemiologiche, microbiologiche e ambientali non hanno messo in evidenza una possibile fonte comune di esposizione dei casi. Tuttavia, i ceppi di Lp1, isolati da campioni d’acqua prelevati presso impianti idrici delle abitazioni dei casi e un solo isolato clinico, sottoposti a tipizzazione genomica, hanno mostrato lo stesso Sequence Type (dati ancora in fase di pubblicazione), facendo sospettare che la contaminazione potesse derivare dall’acqua municipale.
La clorazione di tale acqua ha portato infatti a una riduzione dei casi. Sono stati notificati anche altri due cluster legati alla contaminazione di condomini, mettendo in evidenza che tali edifici, seppure non appartenenti alle strutture prioritarie identificate dal Decreto Legislativo n. 18 del 23 febbraio 2023 e s.m.i. (13), e quindi non sottoposti a tale regolamentazione, possono essere fonte di infezione. In questi casi si deve raccomandare agli amministratori di verificare periodicamente nelle parti di impianto comuni, la presenza di Legionella, mentre per impianti idrici dei singoli appartamenti dovrebbero essere diffuse informazioni sulla pulizia dei punti distali (rompigetto, soffioni e tubi flessibili delle docce) e loro periodica sostituzione. Anche il periodico flussaggio dell’acqua, da effettuare quasi su base giornaliera, risulta un fattore importante per ridurre la contaminazione da Legionella, soprattutto quando l’impianto non è stato utilizzato per diversi giorni e sono presenti persone più suscettibili all’infezione (13). Inoltre, numerosi studi hanno descritto la presenza di un’associazione tra aumento delle temperature ambientali e incidenza dei casi di legionellosi sottolineando l’impatto del cambiamento climatico anche sul rischio di proliferazione di Legionella negli ambienti idrici, che si amplifica in condizioni di inadeguata gestione degli edifici sia pubblici che privati (14-16).
L’elevato numero di casi di legionellosi registrato in Italia impone quindi una serie di considerazioni in termini di prevenzione e controllo. Con il Decreto Legislativo 18/2023 che recepisce la direttiva del 2020/2184 del Parlamento europeo e del Consiglio del 16 dicembre 2020, riguardante la qualità delle acque destinate al consumo umano, per la prima volta nel nostro Paese, è stato introdotto obbligatoriamente il monitoraggio del parametro Legionella nelle acque destinate al consumo umano in edifici prioritari (13, 17).
A supporto dell’attuazione del decreto, sono stati elaborati e pubblicati dall’ISS una serie di documenti tecnici:
- “Linee guida per la valutazione e la gestione del rischio per la sicurezza dell’acqua nei sistemi di distribuzione interni degli edifici prioritari e non prioritari e in talune navi ai sensi della Direttiva (UE) 2020/2184”, il cui obiettivo è quello di fornire indirizzi, elementi di conoscenza e strumenti operativi per la gestione dei sistemi idraulici in contesti specifici, al fine di valutare, individuare e controllare le potenziali fonti di pericoli chimici e microbiologici, nonché sviluppare programmi di ispezione/verifiche per specifici parametri, come piombo e Legionella (2);
- “Linee guida nazionali per l’implementazione dei Piani di Sicurezza dell’Acqua”, per garantire un’attuazione sostenibile, armonizzata e controllata su tutto il territorio nazionale a tutela della salute pubblica (18);
- “Linee guida per l’approvazione dei Piani di Sicurezza dell’Acqua per le forniture idropotabili”. Questo documento: fornisce indicazioni per aiutare i gestori delle risorse idriche e gli auditor nel proprio lavoro; chiarisce cosa devono fare i gestori, descrivendo il processo di gestione e valutazione dei PSA; menziona le parti coinvolte e gli obblighi necessari; presenta la piattaforma AnTeAarea PSA, che facilita l'interazione tra i vari attori e gestisce dati durante l'intero processo; descrive la formazione per gli auditor dei PSA, essenziale per il loro ruolo nel "Gruppo nazionale di esperti" per la verifica e approvazione del PSA, come indicato nell'articolo 19 del DLvo 18/2023 e successive modifiche (19).
È inoltre in fase di aggiornamento e revisione un ulteriore documento di rilevanza nazionale, le “Linee Guida per la prevenzione e controllo della legionellosi”, approvate in Conferenza Stato- Regioni nella seduta del 7 maggio 2015, che nella nuova versione riguarderà prevalentemente le acque escluse dal DLvo 18/2023 e s.m.i.
Il DLvo 23 febbraio 2023 n. 18 prevede, per gli inadempienti, sia il reato che l’applicazione di sanzioni. Si dovrà tuttavia attendere il 2029, anno in cui il decreto dovrà essere pienamente attuato, con l’applicazione dei PSA negli ospedali e con i piani di autocontrollo negli altri edifici prioritari, per valutare gli effetti della nuova normativa.
Infine, si raccomanda ai laboratori ospedalieri l’uso di più metodi per la ricerca di Legionella e in particolare l’uso della Real Time PCR eseguita sulle secrezioni respiratorie considerando che dei tre metodi di diagnosi che confermano il caso (coltura, antigene urinario e sierologico) nessuno è specifico e sensibile al 100%. La Real Time PCR infatti, come dimostrato da alcuni studi, aumenta del 18%-30% la rilevazione di casi di legionellosi (20, 21). Per questo motivo verrà inclusa nella prossima revisione della definizione di caso di legionellosi a livello europeo, come metodo diagnostico che in caso di positività conferma la diagnosi di legionellosi. È sempre importante, in caso di esito positivo, eseguire la coltura della secrezione respiratoria per poter isolare il ceppo clinico ed effettuare il confronto genomico con i ceppi ambientali possibilmente responsabili dell’infezione. A questo proposito si vogliono sensibilizzare i medici a prelevare quanto più possibile le secrezioni delle basse vie respiratorie dal paziente, soprattutto in contesti epidemici, per consentire con maggiore probabilità di individuare l’origine dell’infezione ed evitare che altri casi possano verificarsi.
Conflitti di interesse dichiarati: nessuno.
Finanziamenti: nessuno.
Authorship: tutti gli autori hanno contribuito in modo significativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- Correia AM, Ferreira JS, Borges V, Nunes A, Gomes B, Capucho R, et al. Probable Person-to- Person Transmission of Legionnaires' disease. N Engl J Med 2016;374(5):497-8. doi: 10.1056/ NEJMc1505356
- Gruppo di lavoro ad hoc sulla sicurezza dell’acqua nei sistemi di distribuzione idrica interni degli edifici e di talune navi. Linee guida per la valutazione e la gestione del rischio per la sicurezza dell’acqua nei sistemi di distribuzione interni degli edifici prioritari e non prioritari e in talune navi ai sensi della Direttiva (UE) 2020/2184. Roma: Istituto Superiore di Sanità; 2022. (Rapporti ISTISAN 22/32).
- Ministero della Salute. Linee guida per la prevenzione ed il controllo della legionellosi. 7 maggio 2015. www.salute.gov.it/...; ultimo accesso 14/1/2026.
- European Commission. Commission implementing decision (EU) 2018/945 of 22 June 2018 on the communicable diseases and related special health issues to be covered by epidemiological surveillance as well as relevant case definitions. eur-lex.europa.eu/...; ultimo accesso 14/1/2026.
- Conferenza Permanente per i Rapporti tra lo Stato, le Regioni e le Province Autonome di Trento e Bolzano. Provvedimento 13 gennaio 2005. Accordo, ai sensi dell’articolo 4 del decreto legislativo 28 agosto 1997, n. 281, tra il Ministero della salute e i presidenti delle regioni e delle province autonome, avente ad oggetto “Linee guida recanti indicazioni ai laboratori con attivita' di diagnosi microbiologica e controllo ambientale della legionellosi”. Gazzetta Ufficiale - Serie Generale n. 29, 5/2/2005. www.gazzettaufficiale.it/...; ultimo accesso 14/1/2026.
- ISO 11731:2017. Water quality-Enumeration of Legionella. ISO: Geneva, Switzerland, 2017.
- Mentasti M, Kese D, Echahidi F, Uldum SA, Afshar B, David S, et al. Design and validation of a qPCR assay for accurate detection and initial serogrouping of Legionella pneumophila in clinical specimens by the ESCMID Study Group for Legionella Infections (ESGLI). Eur J Clin Microbiol Infect Dis 2015;34(7):1387-93. doi: 10.1007/ s10096-015-2363-4
- Mentasti M, Underwood A, Lück C, Kozak- Muiznieks NA, Harrison TG, Fry NK. Extension of the Legionella pneumophila sequence-based typing scheme to include strains carrying a variant of the N-acylneuraminate cytidylyltransferase gene. Clin Microbiol Infect 2014;20(7):O435-41. doi: 10.1111/1469-0691.12459
- Gaia V, Fry NK, Harrison TG, Peduzzi R. Sequencebased typing of Legionella pneumophila serogroup 1 offers the potential for true portability in legionellosis outbreak investigation. J Clin Microbiol 2003;41(7):2932-9. doi: 10.1128/ JCM.41.7.2932-2939.2003
- Helbig J, Bernander S, Castellani Pastoris M, Etienne J, Gaia V, Lauwers S, et al. Pan-European study on culture-proven Legionnaires' disease: distribution of Legionella pneumophila serogroups and monoclonal subgroups. Eur J Clin Microbiol Infect Dis 2002;21(10):710-6. doi: 10.1007/s10096-002-0820-3
- Rota MC, Caporali MG, Giannitelli S, Urciuoli R, Scaturro M, Ricci ML. La sorveglianza nazionale della legionellosi: risultati relativi all'anno 2022. Boll Epidemiol Naz 2023;4(1):25-32. doi: doi.org/10.53225/BEN_062
- Rota MC, Caporali MG, Scaturro M, Girolamo A, Andrianou X, Ricci ML. Legionella pneumophila and SARS-COV-2 co-infection: the importance of laboratory diagnosis. Letter. Ann Ist Super Sanita 2021;57(3):199-200. doi: 10.4415/ANN_21_03_01
- Italia. Decreto Legislativo 23 febbraio 2023, n. 18. Attuazione della direttiva (UE) 2020/2184 del Parlamento europeo e del Consiglio, del 16 dicembre 2020, concernente la qualità delle acque destinate al consumo umano. Gazzetta Ufficiale - Serie Generale n.55, 6/3/2023.
- European Center for Disease Prevention and Control. Surveillance Atlas of Infectious Diseases. atlas.ecdc.europa.eu/...; ultimo accesso 14/1/2026.
- Montagna MT, Brigida S, Fasano F, Leone CM, D'Ambrosio M, Spagnuolo V, Lopuzzo M, Apollonio F, Triggiano F, Caringella ME, De Giglio O. The role of air temperature in Legionella water contamination and legionellosis incidence rates in southern Italy (2018-2023). Ann Ig 2023;35(6):631- 40. doi: 10.7416/ai.2023.2578
- Walker JT. The influence of climate change on waterborne disease and Legionella: a review. Perspect Public Health 2018;138(5):282-6. doi: 10.1177/1757913918791198
- Unione Europea. Direttiva (UE) 2020/2184 del Parlamento Europeo e del Consiglio del 16 dicembre 2020 concernente la qualità delle acque destinate al consumo umano. eur-lex.europa.eu/...; ultimo accesso 14/1/2026.
- Gruppo Nazionale di lavoro per la redazione delle Linee guida nazionali per l’implementazione dei PSA. Linee guida nazionali per l’implementazione dei Piani di Sicurezza dell’Acqua. Roma: Istituto Superiore di Sanità; 2022. (Rapporti ISTISAN 22/33).
- Daniela Mattei, Valentina Fuscoletti, Camilla Marchiafava, Luca Lucentini e il Gruppo di lavoro “Linee guida per l’approvazione dei PSA”. Linee guida per l’approvazione dei Piani di Sicurezza dell’Acqua per le forniture idropotabili. Roma: Istituto Superiore di Sanità; 2025. (Rapporti ISTISAN 25/4).
- Ricci ML, Grottola A, Fregni Serpini G, Bella A, Rota MC, Frascaro F, et al. Improvement of Legionnaires' disease diagnosis using real-time PCR assay: a retrospective analysis, Italy, 2010 to 2015. Euro Surveill 2018;23(50):1800032. doi: 10.2807/1560- 7917.ES.2018.23.50.1800032
- Avni T, Bieber A, Green H, Steinmetz T, Leibovici L, Paul M. Diagnostic Accuracy of PCR Alone and Compared to Urinary Antigen Testing for Detection of Legionella spp.: a Systematic Review. J Clin Microbiol 2016;54(2):401-11. doi: 10.1128/ JCM.02675-15

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale