Durata dell’isolamento dei casi COVID-19 nella prima ondata epidemica in una ASL della Città Metropolitana di Torino
Carlo Mamoa, Marco Dalmassoa, Osvaldo Pasqualinia, Denis Quartaa, Dario Catozzib, Fabrizio Ciglianob, Erika Pompilib, Angela Gallonec, Giuseppe Grecoc, Enrico Procopioc, Annalisa Castellac
aServizio Sovrazonale di Epidemiologia, ASL TO3, Grugliasco (TO)
bDipartimento di Scienze della Sanità Pubblica e Pediatriche, Università degli Studi di Torino
cServizio di Igiene e Sanità Pubblica, ASL TO3, Rivoli (TO)
Citare come segue: Mamo C, Dalmasso M, Pasqualini O, Quarta D, Catozzi D, Cigliano F, Pompili E, Gallone A, Greco G, Procopio E, Castella A. Durata di isolamento dei casi COVID-19 nella prima ondata epidemica in un’ASL della Città Metropolitana di Torino. Boll Epidemiol Naz 2021;2(3):26-35. DOI: https://doi.org/10.53225/BEN_021
Duration of isolation for COVID-19 cases during the first wave of pandemic in a Local Health Unit of Metropolitan City of Turin, Italy
Introduction
Aim of the study was to describe time for discharging patients from isolation at home during the first wave of pandemic in Italy. These data were used to discuss appropriateness and efficacy of the criteria adopted in accordance with national regulation and early WHO recommendations.
Materials and methods
The information platform used during the COVID-19 epidemic by the Piedmont region collects, among others, information on the sequence of molecular tests performed on confirmed cases. Study population was composed of 4,360 people resident in the area of the Local Health Unit TO3 of the Metropolitan City of Turin (Piedmont region, Italy) who resulted positive to COVID-19 from 1st March 2020 until 15th July 2020. We analysed the data from detection of SARS-CoV-2 by RT-PCR test to recovery. Indicators were stratified by sex, age, district of residence, epidemic phase, presence/absence of symptoms, and status (citizen, social health worker, resident in nursing homes).
Results
Mean recovery time was 37.8 days for women, 38.4 days for men, 31.4 days for healthcare workers. The mean recovery time by age class varied from 31.8 (0-14 yrs.) to 42.7 days (over 80 yrs).
Discussion and conclusions
There is evidence that patients whose symptoms have resolved may still test positive for the COVID-19 virus (SARS-CoV-2) by RT-PCR for many weeks after recovery. Despite positive test result, these patients are not likely to be infectious and are unlikely to be able to transmit the virus to another person. The results of this study confirm the appropriateness of the updated WHO recommendations on the criteria for discharging patients from isolation, suggesting not to use testing as part of the release criteria.
Key words: COVID-19; isolation; recovery
Introduzione
Nel percorso di guarigione di un soggetto in seguito a infezione da SARS-CoV-2, si possono individuare due fasi consecutive ma distinte: la “guarigione clinica” da eventuali segni e sintomi di COVID-19 e la clearance (eliminazione) del virus.
Con il termine clearance si intende la scomparsa di RNA del SARS-CoV-2 rilevabile nei fluidi corporei, sia in persone che hanno manifestato segni e sintomi di malattia (soggetti sintomatici), sia in persone che non li hanno presentati (soggetti asintomatici fin dal principio). Tale eliminazione solitamente si accompagna alla comparsa di anticorpi specifici di tipo IgG per il virus SARSCoV- 2 prodotti dall’organismo. Un soggetto clinicamente guarito può risultare comunque ancora positivo al test per la ricerca di SARS-CoV-2.
Al fine di verificare la definitiva non contagiosità dei soggetti infettati, le prime raccomandazioni dell'Organizzazione Mondiale della Sanità (OMS) per confermare la clearance del virus SARS-CoV-2 si basavano sulla guarigione clinica e sul riscontro di due test molecolari (RT-PCR) negativi eseguiti a distanza di 24 ore (1). Queste raccomandazioni tenevano conto di analoghe esperienze di epidemie da coronavirus, come quelle che hanno causato SARS e MERS e sono state adottate in tutti i Paesi interessati dalla pandemia.
In accordo con queste indicazioni, in Italia, durante la prima fase della pandemia, un paziente COVID-19 veniva certificato “guarito”, quindi non più potenzialmente infettivo, quando, oltre ad aver risolto segni e sintomi dell’infezione da SARS-CoV-2, risultava negativoa due test RT-PCR consecutivi per la ricerca del virus SARS-CoV-2, eseguiti a distanza di 24 ore uno dall’altro (3). Veniva seguita l’indicazione di effettuare i test per documentare la negativizzazione non prima di 14 giorni (durata raccomandata del periodo d’isolamento) dal riscontro della positività, soprattutto nei casi sintomatici.
Con nuove linee guida relative alla gestione clinica (4), a giugno 2020 l’OMS ha rivisto i criteri di interruzione dell’isolamento, suggerendo di non basarsi sui test ma sulla presenza di sintomi:
- per i casi sintomatici: 10 giorni dopo la comparsa dei sintomi, più almeno tre giorni senza sintomatologia;
- per i casi asintomatici: 10 giorni dopo la positività al test per SARS-CoV-2.
L’OMS ha lasciato comunque ai singoli Paesi la scelta se continuare a utilizzare i due test RT-PCR negativi come criterio per il rilascio dall’isolamento. L’Italia è tra i Paesi che ha continuato a seguire il criterio del doppio tampone negativo, fino alla Circolare del Ministero della Salute del 12 ottobre 2020 (5), che ha parzialmente ridotto il periodo di isolamento, ma continuando a richiedere almeno un test di controllo.
Questo contributo intende descrivere l’esperienza della sorveglianza dei soggetti affetti da COVID-19 durante i primi mesi della pandemia (da marzo a maggio 2020), residenti o domiciliati nel territorio di competenza della ASL TO3, attraverso l’analisi dei tempi e percorsi di guarigione (intesa come fine dell’isolamento) dei soggetti positivi al SARS-CoV-2.
L’obiettivo è trarne spunti utili a commentare appropriatezza ed efficienza delle procedure adottate in Italia durante la prima ondata della pandemia per certificare la guarigione, alla luce delle difficoltà organizzative e delle conoscenze emerse sulla durata della contagiosità nei soggetti affetti da COVID-19.
Materiali e metodi
Fonte dei dati
I dati di questo studio sono stati raccolti con la piattaforma web attivata in Piemonte a supporto dell’epidemia COVID-19 e utilizzata per la sorveglianza epidemiologica dalle strutture del Servizio Sanitario Regionale (SSR), fra cui i Servizi di Igiene e Sanità Pubblica (SISP) delle ASL. La piattaforma raccoglie dati anagrafici, clinici e referti dei soggetti sottoposti a sorveglianza COVID-19 (casi sospetti, contatti stretti, soggetti sottoposti a screening, casi accertati). Per il periodo oggetto di analisi in questo studio (1° marzo-15 luglio 2020 con dati aggiornati al 4 settembre 2020), sulla piattaforma erano disponibili le seguenti informazioni anagrafiche: genere, data di nascita, Comuni di residenza e domicilio, tipologia del soggetto (cittadino, operatore sanitario, operatore/ospite di struttura socio-assistenziale, SSA). Le informazioni cliniche includevano: presenza/assenza di sintomi, data di inizio dei sintomi, descrizione dei sintomi, eventuale ricovero.
Gli operatori responsabili della sorveglianza hanno inserito in piattaforma per ogni soggetto le principali fasi di decorso (ad esempio, quarantena, isolamento, ricoverato, deceduto, guarito).
Il percorso di guarigione dei casi COVID-19 è stato indagato in base ai decorsi, alla sequenza dei tamponi effettuati e ai relativi esiti.
Per migliorare la qualità della classificazione della tipologia di soggetto sono state utilizzate due ulteriori fonti gestite dalla ASL TO3: l’elenco degli operatori e degli ospiti delle SSA presenti sul territorio, costituito da 12.944 osservazioni e l’elenco dei dipendenti della ASL TO3, costituito da 4.835 osservazioni. Le fonti utilizzate sono aggiornate al 4 settembre 2020.
Popolazione ed eventi in studio
La popolazione della ASL TO3 (territorio di 109 Comuni suddivisi per cinque distretti, che copre l’area occidentale della Città Metropolitana di Torino) era costituita al 1° gennaio 2020 da 580.783 persone (Rupar Piemonte - Piemonte Statistica).
Per questo studio sono stati indagati i soggetti residenti, domiciliati od ospitati presso una struttura sanitaria di un Comune afferente alla ASL TO3 per i quali sia presente almeno un test molecolare con esito positivo, quindi definiti “casi confermati COVID-19” secondo le indicazioni vigenti nel periodo in studio (6).
Allo scopo di individuare i casi in cui la durata della malattia fosse sufficientemente estesa da garantire la ricostruzione dei decorsi, è stato selezionato per le analisi il sottoinsieme di soggetti con data di inizio del percorso antecedente al 15 luglio 2020.
La data di inizio del percorso è rappresentata, per i soggetti sintomatici, dalla data di esordio dei sintomi e, per i soggetti asintomatici, dalla data di diagnosi del primo tampone con esito positivo.
Per ogni soggetto incluso nello studio sono stati considerati il numero di tamponi effettuati a partire dal primo positivo, la sequenza degli esiti dei tamponi e la distanza, misurata in giorni, fra la data di inizio percorso e quella di guarigione.
Definizione di caso guarito
Ogni caso confermato di COVID-19 è sottoposto alle misure di contenimento previste (isolamento fiduciario di almeno 14 giorni o fino a risoluzione dei sintomi), con fine dell’isolamento condizionata dalla presenza di due test molecolari negativi eseguiti a distanza di 24 ore. La fine dell’isolamento si associa alla certificazione di “guarigione” (3). Il termine “guarito” vuole indicare un caso COVID-19 che, oltre a non avere più manifestazioni cliniche, può considerarsi non infettivo, quindi in grado di riprendere la normale attività sociale e lavorativa.
Definizione di caso “ripositivizzato”
Si considera “ripositivizzato” un soggetto in cui viene riscontrato un test molecolare con esito positivo eseguito successivamente alla certificazione di guarigione. La ripositivizzazione non viene necessariamente intesa come sinonimo di reinfezione.
Analisi statistica
Per i soggetti con almeno un tampone con esito positivo, denominati “casi confermati COVID-19”, è riportata la distribuzione per decorso (guarito, deceduto, altro), il tasso di guarigione e il tasso di letalità calcolati alla fine del periodo di osservazione. I risultati sono stratificati per genere, fascia di età, distretto sanitario, periodo di positivizzazione (fase 1: fino al 3 maggio 2020; fase 2: dal 4 maggio 2020), presenza di sintomi, tipologia di soggetto (cittadino, operatore SSA, ospite SSA, operatore sanitario) e percorso di guarigione, definito in base alla sequenza dei tamponi eseguiti. L’attribuzione del distretto sanitario è stata effettuata in base al Comune di residenza o di domicilio (se diverso da quello di residenza); per gli ospiti delle SSA (anziani, minori, disabili, psichiatrici) è stato considerato il Comune in cui è ubicata la struttura. Il confronto statistico tra frequenze è stato effettuato tramite il test del χ2. L’analisi dei dati è stata effettuata con il software statistico SAS System versione 9.4.
Risultati
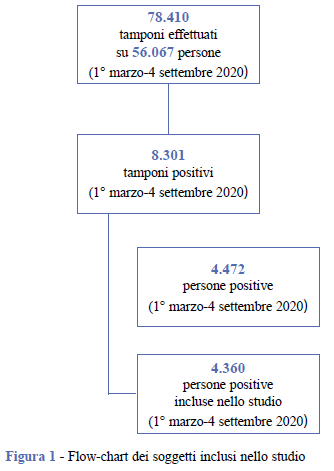
Dal 1° marzo al 4 settembre 2020 sono stati effettuati, nella ASL TO3, 78.410 tamponi su un totale di 56.067 persone. I tamponi positivi sono stati pari a 8.301 per un totale di 4.472 casi confermati di COVID-19. In questo studio sono stati selezionati 4.360 casi nel periodo dal 1° marzo al 15 luglio 2020 per garantire la ricostruzione dei decorsi (Figura 1).
Le caratteristiche dei casi confermati COVID-19 in studio sono riportate in Tabella 1, suddivise per soggetti guariti, deceduti e in isolamento.
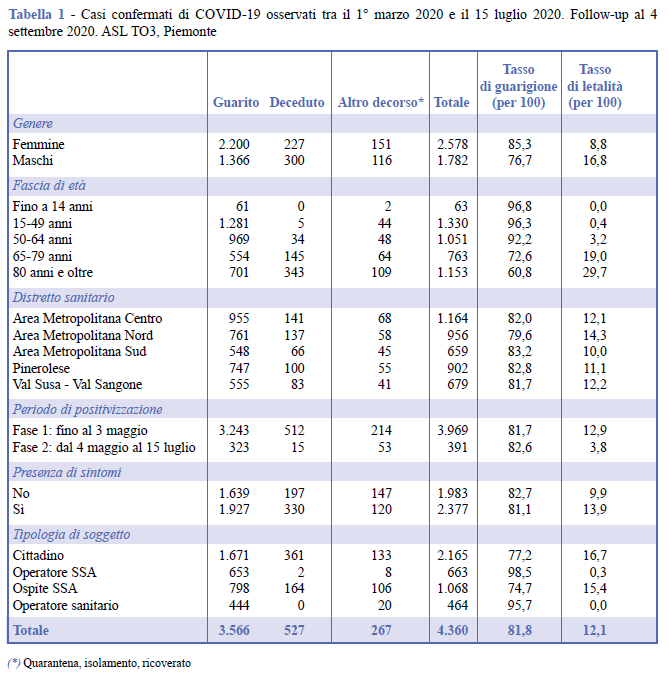
Nella Tabella 1 sono riportati, inoltre, il tasso di guarigione e il tasso di letalità (per 100). I due indicatori hanno una distribuzione per età come atteso, una inversa dell’altra: il tasso di letalità aumenta al crescere dell’età e di conseguenza il tasso di guarigione decresce con l’età. Nella fascia più anziana si osserva la più bassa percentuale di guarigioni: 60,8%; in questa fascia di età, come è noto, si osserva anche una maggiore letalità.
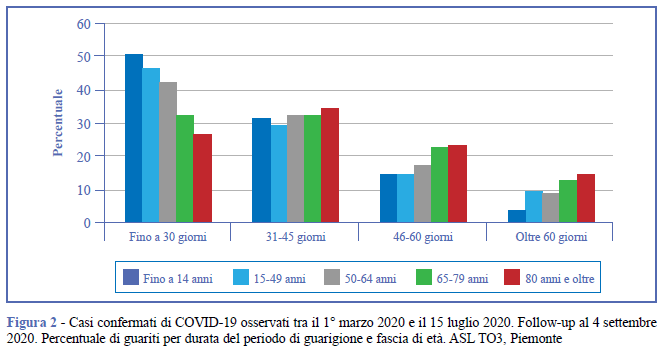
In Figura 2 è riportata la percentuale di soggetti guariti suddivisi per durata del periodo di guarigione e fascia di età, che evidenzia le forti differenze riscontrate fra le diverse fasce di età in relazione al tempo di guarigione. Tali differenze sono risultate statisticamente significative (p<0,010).
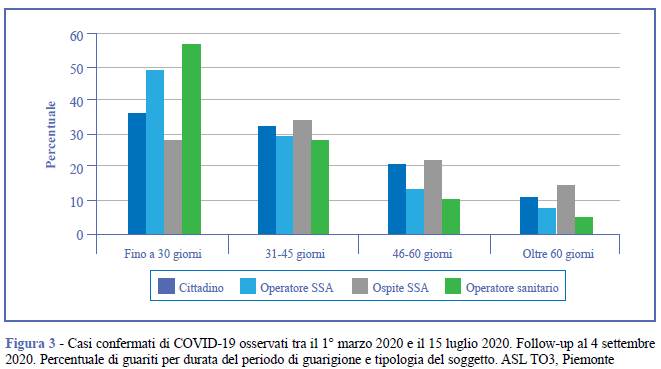
In Figura 3 è riportata la percentuale di soggetti guariti suddivisi per durata del periodo di guarigione e tipologia del soggetto. La figura mostra percentuali di guarigione entro 30 giorni significativamente più alte (p<0,010) per gli operatori sanitari e di SSA.
In Tabella 2 sono riportati i principali indicatori (numero di tamponi effettuati, tempo di guarigione, percentuale di soggetti con tampone nuovamente positivo dopo guarigione) relativi ai 3.566 soggetti guariti.
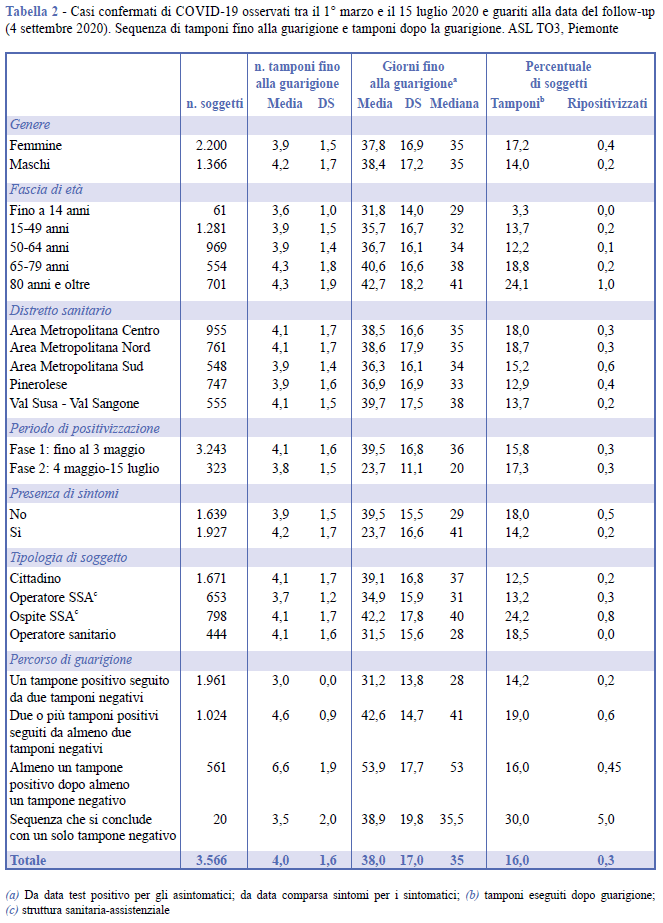
Lievi differenze nel percorso di guarigione si osservano in relazione al genere, sebbene non statisticamente significative; gli indicatori di guarigione risultano infatti leggermente migliori nelle donne rispetto agli uomini: il numero medio di tamponi nelle donne è di 3,9 (4,2 negli uomini) e la media dei giorni utili alla guarigione è 37,8 (38,4 negli uomini).
Il percorso di guarigione risulta più rapido nelle fasce di età giovanili, allungandosi progressivamente al crescere dell’età. Nella fascia di età fino a 14 anni, che registra un numero ridotto di casi, la media dei tamponi effettuati fino alla guarigione risulta di 3,6 e il tempo di guarigione medio è di 31,8 giorni, a fronte di corrispondenti valori, nella fascia più anziana (ultraottantenni), di 4,3 tamponi e 42,7 giorni. Nella fascia più anziana si osserva la più bassa percentuale di guarigioni: 60,8% (Tabella 1).
Non emergono differenze rilevanti nel valore degli indicatori considerati rispetto al distretto sanitario di residenza. Il percorso di guarigione risulta più complesso per i soggetti con sintomi (in media 4,2 tamponi e 43,2 giorni) rispetto ai soggetti asintomatici (con valori rispettivamente di 3,9 tamponi e 32,1 giorni).
Differenze significative riguardano la tipologia dei soggetti: gli ospiti delle SSA hanno i valori più alti degli indicatori considerati (in media 4,1 tamponi e 42,2 giorni), mentre i valori più bassi riguardano gli operatori SSA (3,7 tamponi e 34,9 giorni) e, solo per quanto riguarda il tempo di guarigione, gli operatori sanitari (31,5 giorni).
Il percorso minimo di guarigione, caratterizzato da un solo tampone con esito positivo seguito da due tamponi con esito negativo, interessa 1.961 casi, pari al 55%; questo gruppo mostra il valore più basso della durata media di guarigione (31,2 giorni).
In 1.024 casi (28,7%), la guarigione è attestata dalla presenza di due tamponi conclusivi con esito negativo preceduti da due o più tamponi iniziali con esito positivo, registrando un valore medio della durata di guarigione di 42,6 giorni. In 561 casi (15,7%), il percorso di guarigione risulta meno lineare, con la presenza intermedia di almeno un tampone positivo che segue almeno un precedente tampone negativo; per questo gruppo, il valore medio della durata di guarigione sale a 53,9 giorni.
In 20 casi (0,6%), infine, la guarigione ha una sequenza di tamponi che si conclude con un solo esito negativo, con una durata media di 38,9 giorni, leggermente maggiore rispetto alla media complessiva (38 giorni); tali anomalie sono solo apparenti, poiché riconducibili al mancato inserimento in piattaforma del risultato di uno dei due test di controllo.
Il numero medio di tamponi effettuati durante il percorso di guarigione e la durata media del periodo di guarigione risultano rispettivamente di 4 e 38, con valori massimi di 17 tamponi e 181 giorni.
Fra i 3.566 soggetti guariti, in 569 casi il monitoraggio si è protratto anche dopo la guarigione, trattandosi di tipologie di pazienti periodicamente sottoposti a controlli (operatori e ospiti SSA).
In 12 soggetti giudicati guariti (0,3%) si è osservata una “ripositivizzazione”. La media dei giorni intercorsi tra data di guarigione e nuova positivizzazione è di 32,8 giorni (mediana 36,5).
Per quattro di questi soggetti (un uomo e tre donne) la ripositivizzazione è riscontrata dopo oltre 90 giorni dalla comparsa dei primi sintomi (range 100-141 giorni); si tratta di soggetti di età compresa tra 79 e 96 anni (media 85,8).
Discussione
La percentuale di guarigioni certificata tra i residenti della ASL TO3 è stata dell’81,8%, valore lievemente superiore rispetto al dato nazionale: in Italia, al 4 settembre 2020 la percentuale di guariti era del 76,1% (8).
L’età mediana dei casi registrati nella ASL TO3 è stata di 55 anni e le donne erano il 59,1%; l’età mediana dei casi italiani è stata nel periodo in esame di 56 anni e le donne erano il 52,3% (9). È probabile che la maggiore percentuale di guarigione sia stata parziale conseguenza di fattori organizzativi, come ad esempio l’allestimento di postazioni con possibilità di accesso in autovettura, che hanno favorito l’effettuazione dei tamponi in tempi più rapidi (10).
Oltre alle attese differenze per età nelle percentuali di guarigione (4), questo studio ha rilevato un decorso relativamente più breve nelle donne rispetto agli uomini. Sembra confermarsi l’ipotesi che il sesso femminile, sebbene maggiormente colpito dall’infezione, possa avere un decorso migliore, come indicato dai minori tassi di letalità (11).
Queste osservazioni riguardano principalmente pazienti adulti; meno chiari sono questi parametri nei bambini, dove la maggiore risposta immunitaria aspecifica (innata), agendo più precocemente, aiuta a prevenire l’evoluzione della malattia (12), riducendo quindi la quota di casi gravi, con conseguente accorciamento del periodo mediano di guarigione (27 giorni nei casi con meno di 14 anni nella popolazione sotto sorveglianza).
Da rilevare i periodi di guarigione più brevi negli operatori sanitari e di SSA, probabile conseguenza di una popolazione tendenzialmente più giovane, prevalentemente di genere femminile e con migliori condizioni iniziali di salute.
In media, ogni caso COVID-19 ha dovuto effettuare 4 tamponi tra positivizzazione e guarigione: un numero che giustifica l’osservato allungamento dei tempi di guarigione oltre il ragionevole. Nella popolazione della ASL TO3 emerge infatti una mediana di 36 giorni per la guarigione nella fase di lock-down, che diventano 20 giorni nella fase successiva il 4 maggio. Le differenze tra questi due periodi sono dovute alla maggiore percentuale di casi sintomatici (e quindi con periodo di guarigione più lungo) rilevati nella prima fase di epidemia: fino al 4 maggio i pazienti sintomatici rappresentavano il 56,5% dei casi, mentre nel periodo successivo hanno rappresentato il 29% dei casi notificati. Più che a modifiche del quadro epidemiologico, queste differenze sono dovute ai criteri di richiesta dei test molecolari, che hanno riguardato nella prima fase principalmente soggetti sintomatici, allargandosi nel tempo anche ai contatti stretti asintomatici. È inoltre plausibile che le criticità registrate dai Dipartimenti di Prevenzione per la sorveglianza durante la fase 1 si siano ripercosse sull’allungamento dei tempi di guarigione in quei mesi. Sebbene il tempo necessario a essere certificati guariti sia maggiore per i casi insorti nella fase 1, la percentuale di guariti risulta comunque simile a quella dei casi insorti da maggio in poi: 81,7% vs 82,6%.
È stata riscontrata una percentuale, seppur bassa, di soggetti ripositivizzatisi dopo la certificazione di guarigione: solo in quattro soggetti, tutti molto anziani, la ripositivizzazione è occorsa oltre i 90 giorni dalla comparsa dei primi sintomi, facendo sospettare una possibile reinfezione (13). Nei rimanenti casi, il riscontro di un nuovo referto positivo dopo la guarigione è verosimilmente dovuto alla persistenza di RNA virale nella mucosa respiratoria più che a una reinfezione. È noto che le concentrazioni di SARS-CoV-2 RNA misurate nei campioni prelevati da vie respiratorie superiori declina dopo l’inizio dei sintomi (13-17). La probabilità di riscontrare virus competente per la replicazione si riduce anch’essa dopo l’inizio dei sintomi. Nei pazienti che presentano un quadro clinico leggero, virus competente per la replicazione non si è più riscontrato dopo 10 giorni dalla comparsa dei sintomi (15-20). Virus competente per la replicazione si è riscontrato tra i 10 e 20 giorni dalla comparsa dei sintomi solo in alcuni pazienti con quadro clinico severo, soprattutto se immunocompromessi (14). Sebbene il virus replicante non sia stato isolato tre settimane dopo la comparsa di sintomi, i pazienti guariti possono continuare ad avere riscontri di SARS-CoV-2 RNA nei campioni da alte vie respiratorie fino a 12 settimane (21-23). Tuttavia, dopo tale periodo, la possibilità di riscontrare virus replicante in pazienti persistentemente positivi al tampone o con sintomi ricorrenti è molto bassa ed è quasi nulla la probabilità di contagiare eventuali contatti (21). I campioni prelevati in pazienti giudicati guariti da COVID-19, ma nuovamente sintomatici o con nuova ripositivizzazione al test RT-PCR non hanno presentato comunque virus replicante (20, 21).
La richiesta di due test molecolari negativi per poter certificare la fine dell’isolamento ha determinato situazioni particolari, con soggetti relativamente giovani e paucisintomatici che hanno dovuto attendere fino a quattro mesi per ottenere la certificazione di guarigione, quindi con un periodo di isolamento prolungato oltre il ragionevole rischio di infettività.
La lunghezza media dei periodi necessari alla certificazione di guarigione nel periodo in analisi, certificazione rilasciata in base ai criteri indicati dal Ministero della Salute, è stata quindi superiore a quanto giustificabile con le evidenze di laboratorio successivamente emerse. Evidenze che avevano condotto l’OMS a rivedere già a giugno 2020 le indicazioni dei criteri di guarigione, basati soprattutto sulla gravità del quadro clinico e sulle latenze temporali, suggerendo la possibilità di abolire la richiesta di due test molecolari con esito negativo (24).
Tra le motivazioni addotte dall’OMS per non prolungare oltre il necessario l’isolamento dei casi e non definire la guarigione sulla base della negativizzazione al tampone, vi sono l’utilità di non influire sul benessere psichico e la difficoltà organizzativa a eseguire e refertare i test in tempi brevi.
Anche i dati raccolti da questo studio supportano le indicazioni dell’OMS di basare la sorveglianza dei casi positivi sulla sintomatologia e la durata del periodo di isolamento dei casi confermati sulla presenza di sintomatologia, senza necessariamente ricorrere a ulteriori test che non siano specificamente motivati.
Con la Circolare del Ministero della Salute del 12 ottobre 2020 (5), allegata al DPCM 13 ottobre, l’Italia ha modificato i criteri di sorveglianza e certificazione di guarigione, indicando un periodo di isolamento più breve (10 giorni) e la richiesta di un solo tampone di controllo. Alla nota ministeriale è seguita una Circolare regionale con indirizzi operativi aggiornati (25).
Tra i limiti dello studio va sottolineata la mancanza di informazioni sulle comorbidità dei casi positivi, non essendo la piattaforma gestionale COVID-19 in grado di sistematizzare la raccolta di tali informazioni. Si è quindi utilizzata solo la categorizzazione per fasce di età come indicatore di fragilità.
Inoltre, i casi notificati non rappresentano la reale dimensione dell’epidemia, in quanto una percentuale variabile di casi non viene diagnosticata sia perché non effettua il tampone, sia a causa della modesta sensibilità del test e conseguente presenza di “falsi negativi” (26).
Conclusioni
Durante le prime fasi della pandemia sono stati adottati criteri tendenzialmente prudenziali per interrompere l’isolamento dei casi positivi. I risultati ottenuti dalla sorveglianza della popolazione della ASL TO3 e l’analisi dei percorsi di guarigione indicano periodi medi di isolamento di durata non giustificabile con le conoscenze successivamente emerse sulla durata di infettività dei soggetti positivi. Già a giugno 2020 l’OMS forniva indicazioni di interrompere l’isolamento 10 giorni dopo la comparsa dei sintomi, se vi era assenza di sintomi da almeno tre giorni senza uso di farmaci.
Premesso che i test sierologici non dovrebbero essere utilizzati per testare la presenza o l’assenza di infezione o reinfezione, l’OMS suggerisce di seguire una strategia basata sui test di laboratorio per certificare la guarigione solo in quei casi in cui si vuole accorciare il periodo di isolamento, in soggetti a contatto con pazienti fragili o in casi con sintomatologia prolungata.
I soggetti guariti che sviluppano nuovi sintomi attribuibili a COVID-19 nei tre mesi seguenti la comparsa dei primi sintomi, escluse altre possibili cause, possono essere ritestati e l’isolamento può essere nuovamente prescritto durante la fase di valutazione, soprattutto se i nuovi sintomi compaiono entro 14 giorni dal contatto stretto con un soggetto infetto.
Le indicazioni fornite dal Ministero della Salute a ottobre 2020, raccogliendo in parte i suggerimenti dell’OMS, hanno inaugurato di fatto una nuova fase della sorveglianza.
Conflitti di interesse dichiarati: nessuno.
Finanziamenti: nessuno.
Authorship: tutti gli autori hanno contribuito in modo signifi cativo alla realizzazione di questo studio nella forma sottomessa.
Riferimenti bibliografici
- World Health Organization. Laboratory testing of human suspected cases of novel coronavirus (nCoV) infection. Interim guidance 10 January 2020. WHO/2019-nCoV/laboratory/2020.1. https://www.who.int/...; ultimo accesso 18/10/2021.
- Ministero della salute. Direzione Generale della Prevenzione Sanitaria. Circolare del 29 febbraio 2020. Prot. n. 0006607-29/02/2020-DGPREDGPRE- P. Parere del Consiglio Superiore di Sanità: definizione di Paziente guarito da Covid-19 e di paziente che ha eliminato il virus SARS-CoV-2. https://www.sigg.it/...; ultimo accesso 18/10/2021.
- Comitato Tecnico Scientifico (CTS). Protezione Civile - Ministero della Salute. Comunicazione del CTS sulla definizione di paziente guarito. 19 marzo 2020. https://www.salute.gov.it/...; ultimo accesso 18/10/2021.
- World Health Organization. Clinical Management of COVID-19: interim guidance, 27 May 2020. WHO/2019-nCoV/clinical/2020.5. https://apps.who.int/...; ultimo accesso 18/10/2021.
- Ministero della Salute. Circolare del 12 ottobre 2020. Prot. 0032850-12/10/2020-DGPRE-DGPRE-P. COVID-19: indicazioni per la durata ed il termine dell’isolamento e della quarantena. https://www.trovanorme.salute.gov.it/...; ultimo accesso 18/10/2021.
- Peralta-Santos A. Assessment of COVID-19 surveillance case definitions and data reporting in the European Union. Policy Department for Economic, Scientific and Quality of Life Policies Directorate- General for Internal Policies. July, 2020 https://www.europarl.europa.eu/...; ultimo accesso 18/10/2021.
- Italia. Decreto del Presidente del Consiglio dei Ministri del 26 aprile 2020. Ulteriori disposizioni attuative del decreto-legge 23 febbraio 2020, n. 6, recante misure urgenti in materia di contenimento e gestione dell'emergenza epidemiologica da COVID-19, applicabili sull'intero territorio nazionale. (20A02352) Gazzetta Ufficiale - Serie Generale n.108 del 27 aprile 2020.
- Ministero della Salute. Protezione Civile. Covid-19 Situazione in Italia. http://opendatadpc.maps.arcgis.com/...
- Istituto Superiore di Sanità. Dati della Sorveglianza integrata COVID-19 in Italia. https://www.epicentro.iss.it/...
- Pompili E, Catozzi D, Cigliano F, Dalmasso M, Pasqualini O, Amprino V, et al. F. Organizzazione e sviluppo di un modello drive-through per l’esecuzione di tamponi in risposta alla pandemia di COVID-19: l’esperienza di una azienda sanitaria locale nel Nord Italia. E&P Repository. repo.epiprev.it/1962
- Caselli G, Egidi V. Gender differences in COVID-19 cases and death rates in Italy. Ital J Gender-Specific Med 2020;6(3): 96-9. doi: 10.1723/3432.34213
- Pierce CA, Preston-Hurlburt P, Dai Y, Burn Aschner C, Cheshenko N, Galen B, et al. Immune responses to SARS-CoV-2 infection in hospitalized pediatric and adult patients. Sci Transl Med 2020;12(564):eabd5487. doi: 10.1126/scitranslmed. abd5487
- Center for Disease Control and Prevention (CDC). Interim Guidance on Ending Isolation and Precautions for Adults with COVID-19. Updated March 16, 2021. https://www.cdc.gov/...
- van Kampen JJA, van de Vijver DAM, Fraaij PLA, Haagmans BL, Lamers MM, Okba N, et al. Shedding of infectious virus in hospitalized patients with coronavirus disease-2019 (COVID-19): duration and key determinants. (Preprint) Medrxiv 2020.06.08.20125310. doi: doi.org/10.1101/2020.06.08.20125310
- Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature 2020;581(7809):465-9. doi: 10.1038/s41586-020- 2196-x
- Young BE, Ong SWX, Kalimuddin S, Low JG, Tan SY, Loh J, et al. Epidemiologic Features and Clinical Course of Patients Infected With SARS-CoV-2 in Singapore. JAMA 2020;323(15):1488-94. doi: 10.1001/jama.2020.3204
- Zou L, Ruan F, Huang M, Liang L, Huang H, Hong Z, et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N Engl J Med 2020;382(12):1177-9. doi: 10.1056/nejmc2001737
- Arons MM, Hatfield KM, Reddy SC, Kimball A, James A, Jacobs JR, et al. Presymptomatic SARSCoV- 2 infections and transmission in a skilled nursing facility. N Engl J Med 2020;382(22):2081-90. doi: 10.1056/NEJMoa2008457
- Bullard J, Dust K, Funk D, Strong JE, Alexander D, Garnett L, et al. Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples. Clin Infect Dis 2020;71(10):2663- 6. doi: 10.1093/cid/ciaa638
- Lu J, Peng J, Xiong Q, Liu Z, Lin H, Tan X, et al. Clinical, immunological and virological characterization of COVID-19 patients that test re-positive for SARSCoV- 2 by RT-PCR. EBioMedicine 2020;59:102960. doi: 10.1016%2Fj.ebiom.2020.102960
- Murphy K. SARS CoV-2 Detection From Upper and Lower Respiratory Tract Specimens: Diagnostic and Infection Control Implications. Chest 2020;158(5):1804-5. doi: 10.1016/j.chest.2020.07.061
- Li N, Wang X, Lv T. Prolonged SARS-CoV-2 RNA Shedding: Not a Rare Phenomenon. J Med Virol 2020;92(11):2286-7. doi: 10.1002/jmv.25952
- Xiao F, Sun J, Xu Y, Li F, Huang X, Li H, et al. Infectious SARS-CoV-2 in Feces of Patient with Severe COVID-19. Emerg Infect Dis 2020;26(8):1920-2. doi: 10.3201/eid2608.200681
- World Health Organization. Criteria for releasing COVID-19 patients from isolation. Scientific Brief, 17 June 2020. (Initial recommendation published on 12 January 2020). https://www.who.int/...; ultimo accesso 18/10/2021.
- Dipartimento Interaziendale Funzionale a Valenza Regionale Malattie ed Emergenze Infettive (DIRMEI). Covid-19. Nuove indicazioni per la durata e il termine dell’isolamento e della quarantena. Reimmissione in comunità di soggetti positivi a lungo termine. Parere tecnico valutazione contagiosità. Torino, 26/10/2020.
- Watson J, Whiting PF, Brush JE. Interpreting a covid-19 test result. BMJ 2020;369:m1808. doi: 10.1136/bmj.m1808

 Bollettino epidemiologico nazionale
Bollettino epidemiologico nazionale