Informazioni generali
- La malaria umana è una malattia che può avere esito fatale, causata da protozoi parassiti trasmessi all’uomo da zanzare femmine infette, del genere Anopheles.
- Le abitudini di puntura delle Anopheles sono crepuscolari e notturne, le ore in cui in zone endemiche è più alto il rischio di contrarre la malaria.
- Attualmente la malaria risulta diffusa principalmente in zone tropicali e subtropicali.
- L’Organizzazione Mondiale della Sanità (OMS) definisce la malaria umana una malattia seria, prevenibile e curabile se diagnosticata tempestivamente e trattata con farmaci adeguati.
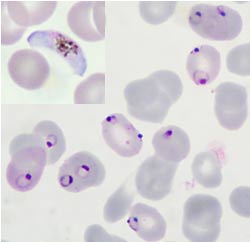
Cos’è la malaria
La malaria è una malattia causata da protozoi parassiti appartenenti al genere Plasmodium il cui ciclo biologico si svolge in due ospiti obbligati, un vertebrato, come ospite intermedio e una femmina di zanzara come ospite definitivo, detto anche vettore.
Le specie di plasmodi responsabili della malaria umana si trasmettono in modo naturale da uomo a uomo mediante la puntura di zanzare infette appartenenti al genere Anopheles; tuttavia, si può verificare trasmissione anche con eventi accidentali mediante contagio ematico diretto.
Nei Paesi endemici rappresenta la malattia trasmessa da vettore più diffusa al mondo, nei Paesi non endemici la più importante malattia d’importazione, legata principalmente ai viaggi in aree tropicali e all’aumento dei flussi migratori.
Distribuzione geografica
Nella prima metà del XX secolo la malaria fu eradicata da gran parte delle aree temperate e oggi risulta diffusa principalmente nei Paesi della fascia tropicale e sub tropicale. In particolare, è altamente endemica in Africa, dove si verificano il maggior numero di casi e di decessi. In Paesi del Sud-est asiatico, del Medio Oriente e dell’Asia Centrale, del Pacifico occidentale e dell’America centrale e meridionale è presente invece con diversi gradi di endemia.
Complessivamente quasi metà della popolazione mondiale, soprattutto quella residente in Paesi poveri, vive in aree a rischio di malaria.
Tuttavia, negli ultimi anni la diffusione della malaria nel mondo è stata notevolmente ridotta grazie all’attuazione di programmi di lotta e controllo promossi dall’OMS e da diverse associazioni internazionali.
Nelle aree non endemiche a clima temperato nonostante l’elevato numero di casi importati e la presenza di vettori competenti sul territorio la possibilità della ricomparsa di una trasmissione locale è da considerarsi estremamente bassa.
I Plasmodi umani
Le specie di plasmodi responsabili della malaria umana sonole seguenti:
- Plasmodium falciparum, agente della cosiddetta terzana maligna (ciclo di replicazione del parassita nel sangue umano, ciclo schizogonico, ogni 48 ore), endemico in Africa sub-Sahariana, Asia ed America Latina, Papua-Nuova Guinea e in alcune isole del Pacifico orientale
- P. vivax, agente della terzana benigna, prevalente in zone a clima temperato, oltre che in Africa orientale, in Asia ed America Latina
- P. ovale, con le due sottospecie P. ovale curtisi e P. ovale wallikeri, agenti di forme di terzana benigna, molto comuni principalmente in Africa occidentale, raramente nel Pacifico;
- P. malariae, responsabile della quartana benigna (ciclo schizogonico ematico ogni 72 ore), diffuso in aree tropicali e sub-tropicali in modo non uniforme e comunque sempre con una frequenza piuttosto bassa
- P. knowlesi, morfologicamente simile a P. malariae, presente in varie aree del Sud-est asiatico e responsabile della malaria di alcune scimmie arboricole di foresta. A causa dei numerosi focolai umani identificati inizialmente in Borneo e poi in molte altre regioni del Sud-est asiatico, dal 2008 P. knowlesi viene considerato a tutti gli effetti la quinta specie di plasmodio responsabile di malaria nell’uomo.
I vettori
In tutto il mondo ci sono più di 400 diverse specie di zanzare Anopheles, circa 60 sono in grado di trasmettere la malaria, solo 30 quelle che hanno la maggiore importanza come vettori di malaria. In ogni area geografica solitamente ci sono non più di 3-4 specie in grado di trasmettere la malaria.
Le zanzare adulte, essendo organismi eterotermi, possono riprodursi e sopravvivere a temperature ambientali non inferiori ai 15-18°C e a un elevato grado di umidità, sempre in presenza di raccolte d’acqua, essenziali per il loro ciclo di sviluppo. Le zanzare depongono le loro uova in acqua, da cui emergono le larve che dopo quattro stadi, impupandosi, daranno origine all’adulto. Gli adulti vivono in media da pochi giorni (i maschi) a diverse settimane (le femmine). Le femmine di zanzara hanno necessità di effettuare dei pasti di sangue ogni 3-4 giorni per la maturazione delle uova. Le abitudini di puntura delle Anopheles sono crepuscolari e notturne, ore in cui in zone di endemia è più alto il rischio di contrarre la malaria.
Ciclo di trasmissione
Una femmina di Anopheles infetta con un pasto di sangue effettuato su un soggetto portatore delle forme sessuate del parassita, i gametociti. Queste sono le uniche forme del plasmodio in grado proseguire lo sviluppo nel corpo della zanzara, la cui durata può essere di qualche giorno o di qualche settimana, a seconda della specie di plasmodio e della temperatura ambiente. Al termine del ciclo di sviluppo, le forme del plasmodio infettanti per l’uomo, gli sporozoiti, migreranno nelle ghiandole salivari della zanzara che li inoculerà al momento della puntura.
All’interno dell’ospite umano, il parassita (endocellulare) si modifica passando attraverso diversi stadi di sviluppo e riuscendo a eludere le difese del sistema immunitario, si localizza prima nel fegato, dove invade gli epatociti e si amplifica per schizogonia, quindi invade i globuli rossi, dove si riproduce nuovamente per schizogonia, dando luogo a nuove generazioni di parassiti ogni 48 (terzana) o 72 (quartana) ore. Dopo alcuni cicli di sviluppo, il plasmodio produce i gametociti che rimarranno nel circolo sanguigno per diverse settimane, in modo da poter infettare altre zanzare.
Sintomi
I sintomi, a seconda della specie di plasmodio, compaiono dopo 7, 15 o più giorni dalla puntura della zanzara infetta. Sono di varia natura, solitamente febbre, spesso molto alta, mal di testa, vomito, diarrea, sudorazioni e brividi scuotenti, tutti sintomi, almeno inizialmente, comuni a quelli di una qualsiasi sindrome influenzale o ad altre infezioni.La patogenicità dei plasmodi è legata alla loro capacità di invadere e distruggere i globuli rossi a cui segue la sintomatologia principale della malattia, rappresentata da accessi febbrili ricorrenti ed anemia.
La malaria da P. falciparum rappresenta la forma più grave in termini di morbosità e mortalità. Raggiunge parassitemie molto elevate e oltre a causare una forte anemia può arrivare a ostruire i capillari del cervello (malaria cerebrale) o di altri organi vitali (reni, milza, fegato). Se non trattata tempestivamente può evolvere in malattia grave e invalidante, e/o portare alla morte.
Le forme di malaria dovute alle altre specie di plasmodio sono in genere meno gravi. La particolarità di P. vivax e P. ovale è che possono dare origine a recidive per via di forme che rimangono silenti nel fegato (ipnozoiti) e che si possono riattivare dopo mesi dall’attacco primario. In questi ultimi anni sono state descritte forme gravi di malaria da infezioni di P. vivax, caratterizzate da edema polmonare, sindrome da distress respiratorio acuto (ARDS) e disfunzione multiorgano.
P. malariae, invece, può dare recrudescenze, anche a distanza di decenni. Forme del parassita possono rimanere nel circolo ematico a livello subclinico in modo da evadere il sistema immunitario e riattivarsi causando un nuovo accesso malarico quando le difese si dovessero abbassare per motivazioni diverse.
P. knowlesi, che presenta il ciclo schizogonico ematico di 24 ore, causa in genere una forma di malaria non complicata, sensibile al trattamento con clorochina. Nella letteratura recente tuttavia sono state descritte diverse forme gravi dovute a questo parassita, sei con esito fatale.
Impatto della malaria
In aree con condizioni di trasmissione elevate, l’esposizione continua alla malattia sviluppa in particolare nella popolazione adulta un'immunità parziale, o adattativa, che sebbene non fornisca una protezione completa, riduce il rischio di malaria grave. In queste aree, la maggior parte dei decessi per malaria si verificano infatti in bambini al di sotto dei 5 anni di età, non avendo ancora sviluppato l’immunità adattativa. Altro gruppo di popolazione a rischio sono le donne in gravidanza che per le peculiarità immunitarie legate al loro stato sono più suscettibili a presentare la malattia in forma acuta, con anemie gravi e crescite fetali compromesse quando non addirittura la morte della madre e/o del feto. Nelle aree con bassa trasmissione dove la popolazione presenta bassa immunità, tutti i gruppi presentano lo stesso rischio di sviluppare malaria grave.
Tuttavia, gli effetti più disastrosi della malaria si hanno negli eventi epidemici. I grandi movimenti migratori interni a un continente favoriscono l’esposizione di popolazioni vulnerabili, al parassita. Inondazioni, instabilità politica, modifiche ambientali anche legate all’attività dell’uomo, mancanza di misure di controllo del vettore, infrastrutture inadeguate per affrontare la malattia e costi di intervento troppo elevati, difficili da sopportare per Paesi a risorse economiche limitate, sono tutti fattori che possono determinare lo sviluppo di eventi epidemici.
In ultimo, altra categoria su cui la malaria può avere un impatto molto importante è rappresentata dai viaggiatori non immuni che si recano in zone endemiche.
Diagnosi e trattamento
Una diagnosi accurata e precoce è una delle chiavi per gestire in modo efficace questa malattia. La pratica diagnostica si basa inizialmente sull’approccio clinico, che con la caratterizzazione dei sintomi indirizza verso un sospetto caso di malaria, e successivamente quello volto a identificare la specie di plasmodio, utilizzando più comunemente la diagnosi microscopica, con eventuale supporto di test rapidi immuno-cromatografici (RDTs) e metodiche molecolari (PCR, Real Time PCR, LAMP).
Attualmente, il miglior trattamento disponibile, in particolare per la malaria da P. falciparum, è rappresentato dalla terapia combinata a base di derivati dell’artemisinina (ACT).
L'OMS raccomanda di confermare con la diagnosi di laboratorio tutti i casi di sospetta malaria prima di somministrare il trattamento terapeutico.
Prevenzione
Chemioprofilassi
La chemioprofilassi è indicata in modo particolare per i viaggiatori diretti in aree endemiche.
Non esiste un unico schema profilattico applicabile ovunque, pertanto la profilassi idonea per chi si rechi in zona di endemia, va studiata caso per caso; la scelta dei farmaci dipende principalmente dal paese visitato, dalla tipologia di viaggio e dal tempo di permanenza.
In area endemica, per le categorie a rischio, quali i bambini sotto i cinque anni di età e le donne in gravidanza, viene raccomandato il trattamento preventivo intermittente.
Misure di controllo del vettore
II controllo del vettore rappresenta una delle misure fondamentali per prevenire e ridurre la trasmissione della malaria. Le principali misure attuate sono focalizzate sulla riduzione del contatto tra zanzare e uomo. Misure di protezione personale contro le punture di zanzara sono rappresentate dalle zanzariere da letto impregnate con insetticida. Gli interventi per la riduzione della densità delle zanzare vengono effettuati con trattamenti con insetticidi ad azione residua nelle abitazioni, con la riduzione dei focolai larvali mediante bonifiche ambientali e con l'uso di larvicidi o predatori naturali di larve di zanzare.
Vaccino contro la malaria
Dopo oltre 30 anni di intensa ricerca, attualmente sono due i vaccini in uso contro la malaria da P. falciparum, noti come RTS,S/AS01 (nome commerciale Mosquirix) e R21/Matrix-M. Raccomandati dall’OMS, entrambi considerati sicuri, efficaci e ben tollerati, stanno svolgendo un ruolo cruciale nel ridurre i tassi di trasmissione e mortalità nella fascia pediatrica in Africa. RTS,S è stato il primo vaccino contro la malaria autorizzato dall’OMS nel 2021, dopo il successo della sua sperimentazione clinica partita nel 2019 e condotta in Ghana, Kenya e Malawi. Lo schema seguito è stato di 4 dosi in bambini di 5-17 mesi, con le dosi inserite nei piani vaccinali di routine di ciascun Paese. Al 2023 risultano somministrate oltre 6 milioni di dosi a più di 2 milioni di bambini. Durante il periodo di somministrazione i risultati hanno mostrato una riduzione del 13% della mortalità e del 22% dei ricoveri ospedalieri per malaria grave nella popolazione infantile vaccinata.
Nell’ottobre 2023 l’OMS ha raccomandato un secondo vaccino, l’R21, per integrare la distribuzione in corso dell’RTS,S, in modo da assicurare forniture sufficienti a prevenire la malaria tra i bambini che vivono in aree endemiche. Questo vaccino che si sta utilizzando in Ghana e Nigeria dal 2023 con uno schema di somministrazione simile all’RST,S ha mostrato livelli di efficacia più alti (intorno al 75%). L’OMS ha suggerito l’uso programmatico della vaccinazione pediatrica in aree a moderata e alta trasmissione, in combinazione con le altre misure di prevenzione già raccomandate e adattate ai contesti locali. A dicembre 2024 la vaccinazione contro la malaria è stata introdotta in 17 Paesi africani. Si prevede che l'espansione nell’uso dei vaccini anti-P. falciparum in Africa potrà salvare la vita a decine di migliaia di bambini ogni anno.
Problematiche emergenti
Resistenza ai farmaci
Il fenomeno della resistenza ai farmaci è un serio problema ricorrente che da sempre ostacola i programmi di lotta alla malaria. Iniziato a fine anni ‘50 con la diffusione della resistenza alla clorochina, questo fenomeno ha poi interessato via via la maggior parte degli antimalarici. A partire dal 2008, purtroppo anche la resistenza ai derivati dell’artemisinina da parte di P. falciparum è emersa e si è diffusa in tutto il Sud-est asiatico. In Africa la resistenza parziale all'artemisinina è ora confermata in Eritrea, Ruanda, Uganda e Repubblica Unita di Tanzania, ed è fortemente sospettata in Etiopia, Sudan, Namibia e Zambia. Sebbene gli studi dimostrino generalmente un'elevata efficacia della terapia combinata a base di artemisinina (ACT), resta alta la preoccupazione che la resistenza a questi farmaci di ultima generazione possa estendersi rapidamente in tutto il resto dei Paesi endemici rendendo vani i progressi raggiunti negli ultimi anni nella lotta alla malaria. Un monitoraggio attento e costante, affiancato da misure incisive, è essenziale per preservare l’efficacia dei farmaci antimalarici a nostra disposizione.
Delezione del gene pfhrp2/3
La maggior parte degli RDTs utilizzati per diagnosticare la malaria da P. falciparum si basano sull’identificazione dell’antigene rappresentato dalle proteine ricche di istidina 2 e 3 (HRP2/HRP3), prodotte dagli stadi asessuati e dai giovani gametociti di P. falciparum ed espresse abbondantemente sulla superficie dei globuli rossi parassitati. Le delezioni dei geni Pfhrp2/3, che codificano per queste proteine, rendono di fatto i parassiti non rilevabili tramite questo tipo di test, compromettendone l’accuratezza diagnostica. Tale fenomeno determina un aumento di risultati falsi negativi e il rischio che infezioni non identificate evolvano in forme di malaria severa anche con esito fatale. Segnalate per la prima volta nel 2010 in Perù, le delezioni dei geni hrp2/3 sono ad oggi confermate in oltre 40 Paesi endemici tra Africa, Asia e Medio Oriente. La prevalenza di queste delezioni varia ampiamente sia tra i diversi Paesi sia all’interno delle singole aree geografiche, ma solo in poche regioni del Sud America e del Corno d’Africa ha raggiunto livelli tali da giustificare necessariamente una modifica nella struttura base dei test rapidi. Tuttavia, attualmente non esistono RDTs in grado di rilevare infezioni da isolati di P. falciparum con delezioni dei geni hrp2/3. Per questo motivo, secondo quanto raccomandato dall’OMS, al momento il monitoraggio attivo di sospetti falsi negativi rappresenta l’unica valida strategia di rilevazione di queste delezioni.
Resistenza agli insetticidi
Anche la comparsa della resistenza delle zanzare agli insetticidi più in uso è da tempo motivo di forte preoccupazione. Tra il 2018 e il 2023, 71 Paesi, di cui 66 attualmente endemici per malaria, hanno segnalato resistenza delle Anopheles vettori di malaria a una o più classi di insetticidi comunemente impiegati per le zanzariere da letto e per i trattamenti ad azione residua nelle abitazioni. Tra i 66 paesi endemici la resistenza ad almeno un insetticida, almeno in un sito di cattura delle zanzare, è stata confermata in 57 paesi (86%). Le zanzariere di nuova generazione, che offrono una protezione migliore contro la malaria rispetto a quelle contenenti solo piretroidi, insetticidi verso cui la resistenza è ampiamente diffusa, stanno diventando sempre più utilizzate e rappresentano uno strumento importante negli sforzi globali per combattere la malattia. L'OMS sottolinea la necessità di sviluppare efficaci strategie di gestione della resistenza agli insetticidi e, nell’attesa dell’immissione sul mercato di nuovi prodotti, l’approccio più efficace per gestire questo problema risulta essere la rotazione dei formulati esistenti e il monitoraggio regolare del fenomeno della resistenza.
Zanzare invasive
La specie Anopheles stephensi, uno dei maggiori vettori di malaria umana originario del subcontinente Indiano, Asia meridionale e Medio Oriente, compresa la penisola arabica, ha esteso in modo preoccupante il suo areale di distribuzione, principalmente verso l’Africa. Dal 2012, anno in cui è stata rinvenuta per la prima volta a Gibuti, in seguito a una epidemia di malaria urbana, la specie si è rapidamente diffusa nel Corno d'Africa, in Etiopia (2016), Sudan (2016), Somalia (2019), Eritrea (2022), Kenya (2022) e successivamente anche in Africa occidentale, in Nigeria (2020) e Ghana (2022). Il comportamento invasivo mostrato da An. stephensi pone seri problemi sul controllo della malaria, considerata ormai vettore principale di P. falciparum e di P. vivax, la sua espansione ha coinciso con un aumento significativo dei casi di malaria in aree a bassa trasmissione e con la comparsa di gravi epidemie. La rapida diffusione di questa zanzara è certamente dovuta alla sua grande plasticità che le ha permesso di adattarsi velocemente a nuove condizioni climatiche e ambientali, proliferando anche in ambiente urbano e periurbano, sia nella stagione delle piogge sia in quella secca, in netta concorrenza con i principali vettori di malaria in Africa. An. stephensi rappresenta una sfida aggiuntiva per il controllo della malaria in Africa. Per fermare l’ulteriore diffusione di questa specie, l’OMS ha lanciato un’allerta per sensibilizzare l’opinione pubblica su questa crescente minaccia e rafforzare la sorveglianza attiva in Africa subsahariana sviluppando adeguati approcci di controllo poiché An. stephensi ha mostrato di essere resistente alla maggior parte degli insetticidi comunemente usati per il controllo della malaria.
- leggi la Circolare del Ministero della Salute, Direzione Generale della Prevenzione Sanitaria, Ufficio 5 Prevenzione delle Malattie Trasmissibili e Profilassi Internazionale “Prevenzione e controllo della malaria in Italia” del 27 dicembre 2016
- leggi le fact sheet OMS sulla malaria
- leggi le fact sheet ECDC sulla malaria.
