Il virus Dengue
Il virus Dengue (DENV) è uno dei membri del genere Orthoflavivirus, appartenente alla famiglia Flaviviridae [1,2]. Il virus si trasmette all'uomo, che rappresenta l’ospite principale, attraverso la puntura di zanzare infette del genere Aedes: l’Aedes aegypti è considerato il vettore principale, ma anche Aedes albopictus (la cosiddetta “zanzara tigre”), sebbene meno competente, è in grado di trasmettere l’infezione [3]. Sono noti 4 sierotipi distinti di DENV (DENV-1, DENV-2, DENV-3, DENV-4) ed è possibile quindi infettarsi più volte con sierotipi diversi. La successiva reinfezione con un sierotipo diverso può esporre al rischio di sviluppare una malattia grave ad esito potenzialmente fatale [4].
La trasmissione all’uomo del DENV avviene durante il pasto di sangue di una zanzara infetta del genere Aedes. L’infezione è, infatti, trasmessa agli esseri umani tramite le punture di zanzare che precedentemente hanno punto una persona infetta. Non si ha quindi contagio diretto tra esseri umani, anche se l’uomo è il principale ospite del virus. Il virus circola nel sangue di una persona infetta per 2-7 giorni e, in questo lasso di tempo, la zanzara può contrarlo con un pasto di sangue e ritrasmetterlo, dopo qualche giorno, ad altre persone.
Ciclo replicativo del virus Dengue
Il virus, di forma sferica e di circa 50 nM di diametro, è dotato di un doppio strato fosfolipidico nel quale si trovano la glicoproteina E (“envelope”) di membrana, il principale determinante antigenico che media il legame al recettore cellulare durante l’infezione e la proteina M (“membrane”).
L’insieme del doppio strato fosfolipidico e delle proteine E e M circonda il nucleocapside costituito da un RNA genomico legato a copie multiple di una piccola proteina basica C (capside). Il DENV si lega alla superficie di una cellula ospite e vi penetra per endocitosi. Una volta entrato, il virus si trova all’interno di vescicole cellulari, gli endosomi, da dove rilascia nel citoplasma il suo materiale genetico in seguito alla fusione della sua membrana con quella endosomiale. La polarità positiva del genoma consente a quest’ultimo, una volta entrato nelle cellule bersaglio, di fungere da RNA messaggero (mRNA) determinando la sintesi di una poliproteina successivamente suddivisa nelle proteine strutturali (E, il precursore della proteina M (prM) e C) e non strutturali (NS) 1, 2A, 2B, 3, 4A, 4B, 5 a opera di proteasi della cellula e della proteasi virale NS2B-3. L’ultima delle proteine non strutturali a essere sintetizzata in ordine di tempo, l’NS5, rappresenta la RNA polimerasi RNA-dipendente (RdRP), direttamente responsabile della duplicazione del genoma e della replicazione del virus. L'assemblaggio delle particelle virali avviene sulla superficie del reticolo endoplasmatico (ER). Le particelle virali immature vengono poi trasportate attraverso il network del trans-Golgi (TGN), dove maturano e si convertono nella loro forma infettiva. I virus maturi vengono quindi rilasciati e possono infettare altre cellule [5].
Il DENV è in grado di infettare diversi tipi cellulari in vitro, comprese le cellule epiteliali, le cellule endoteliali, gli epatociti, le cellule muscolari, le cellule dendritiche, i monociti, le cellule del midollo osseo e i mastociti. I monociti e i macrofagi, derivati da pazienti con malattia grave, presentano antigeni virali [(6]; anche i progenitori eritroidi, i megacariociti e le piastrine si sospetta possano contribuire alla viremia [7]. I recettori cellulari coinvolti nell’infezione in vivo rimangono sconosciuti.
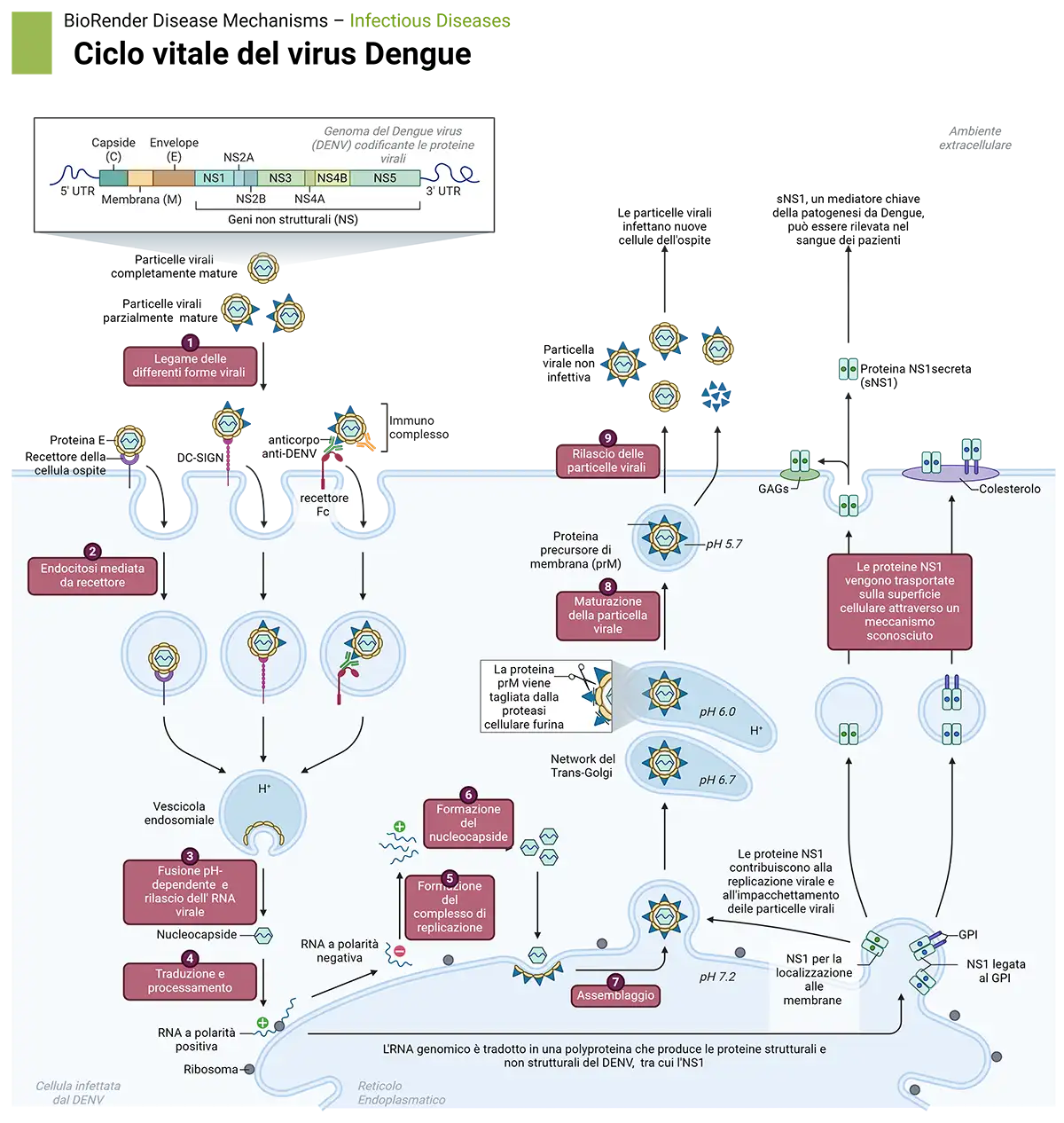
Figura. Struttura del genoma e ciclo replicativo del DENV (Created with BioRender.com)
- leggi le FAQ dell'ISS
Riferimenti
- Guzman, M.G., Gubler, D.J., Izquierdo, A., Martinez, E., Halstead, S.B., 2016. Dengue infection. Nat. Rev. Dis. Prim. 2, 16055. DOI: 10.1038/nrdp.2016.55
- Pierson, T.C., Diamond, M.S., 2020. The continued threat of emerging flaviviruses. Nat. Microbiol. 5, 796–812. DOI: 10.1038/s41564-020-0714-0.
- Bhatt P, Sabeena SP, Varma M, Arunkumar G., 2020. Current Understanding of the Pathogenesis of Dengue Virus Infection. Curr Microbiol. 2021 Jan;78(1):17-32. DOI: 10.1007/s00284-020-02284-w.
- Yuan K, Chen Y, Zhong M, Lin Y, Liu L. Risk and predictive factors for severe dengue infection: A systematic review and meta-analysis. PLoS One. 2022 Apr 15;17(4):e0267186. DOI: 10.1371/journal.pone.0267186.
- Clyde K., Kyle J.L., Harris E. Recent advances in deciphering viral and host determinants of dengue virus replication and pathogenesis. J Virol. 2006 Dec;80(23):11418-31. DOI: 10.1128/JVI.01257-06.
- Halstead S.,B., Antibody, macrophages, dengue virus infection, shock, and hemorrhage: a pathogenetic cascade. Rev Infect Dis 1989 May-Jun;11 Suppl 4:S830-9. DOI: 10.1093/clinids/11.supplement_4.s830.
- Noisakran S., Onlamoon N., Songprakhon P., Hsiao H.,M., Chokephaibulkit K., Perng G.,C. Cells in dengue virus infection in vivo. Adv Virol. 2010;2010:164878. DOI: 10.1155/2010/164878.
